1、填空题 (12分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
化学键
| C—C
| C—H
| H—H
| C—O
| C≡O
| H—O
|
键能/kJ·mol-1
| 348
| 413
| 436
| 358
| 1072
| 463
|
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ?;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min
| 0
| 5
| 10
| 15
| 20
| 25
|
压强/MPa
| 12.6
| 10.8
| 9.5
| 8.7
| 8.4
| 8.4
|
则从反应开始到20min时,以CO表示的平均反应速率=?,该温度下平衡常数K=?,若升高温度则K值?(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是?;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变?
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为?。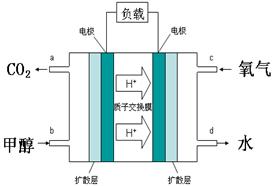
参考答案:(12分) (1) -116 kJ·mol-1?(2) 0.0125 mol·L-1·min-1 , 4 , 减小
(3)AC? (4) 2 CH3OH-12e-+2H2O=2CO2+12H+
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据反应式可知,该反应的△H=1072kJ·mol+2×436kJ·mol-3×412kJ·mol-358kJ·mol-463kJ·mol=-116kJ·mol.
(2)? CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始量(mol)? 1? 2? 0
转化量(mol)? x? 2x? x
平衡量(mol)? 1-x? 2-2x? x
所以有
解得x=0.5
CO表示的平均反应速率是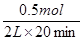 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K=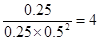 ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以A可以说明;B中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明;反应是体积减小的,所以压强也是减小的,C可以说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选AC。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于质子交换膜只能允许氢离子通过,所以负极电极反应式是2 CH3OH-12e-+2H2O=2CO2+12H+。
本题难度:一般
2、填空题 我国“神舟”号宇宙飞船成功发射并回收,是我国航天史上的里程碑.?飞船上使用的氢氧燃料电池是一种新型的化学电源,它具有高能、轻便、不污染环境的特点.这种燃料电池的构造如右图所示,两个电极均由多空性碳制成,通入的气体由空隙逸出并在电极表面放电.
a极是______极,b极是______极,写出电极反应式a:______;
b:______;
总反应式:______.
参考答案:氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,
由于电解质溶液呈碱性,则负极电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),
正极电极反应式为O2+4e-+2H2O=4OH-,
氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,
为:2H2+O2=2H2O.
故答案为:负;正;负极:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);正极:O2+4e-+2H2O=4OH-;2H2+O2=2H2O.
本题解析:
本题难度:一般
3、选择题 下列对于电化学说法正确的是( )
A.电解精练铜时,阳极泥中常含有金属金、银、锌等
B.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
C.充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
参考答案:A.电解精练铜时,阳极泥中常含有金属金、银等,Zn比Cu活泼,则阳极泥中不含有Zn,故A错误;
B.Cu的活泼性比Fe的弱,Cu作正极,不能保护Fe,所以为保护浸入海水中的钢闸门,一般在闸门表面镶上锌锭,故B错误;
C.充电电池,放电时为原电池,则化学能转变为电能,故C正确;
D.原电池中负极发生氧化反应,电解池中阴极发生还原反应,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 铜片和锌片用导线连接后插入稀硫酸中构成原电池,下列说法正确的是
A.铜片做负极
B.铜片做正极
C.电子从铜片流向锌片
D.锌片上有气体产生
参考答案:B
本题解析:
本题难度:简单
5、选择题 下图为某原电池的结构示意图,下列说法中不正确的是( )
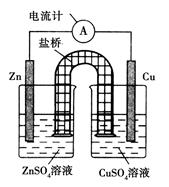
A.原电池工作时的总反应为Zn+Cu2+===Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌的金属性强于铜的,实验锌是负极,失去电子,发生氧化反应。铜是正极,溶液中的铜离子得到电子而析出,所以选项C不正确,其余选项都是正确的,答案选C。
本题难度:一般