1、选择题 目前常用的镍镉蓄电池,其电池总反应可表示为:
Cd+2NiO(OH)+2H2O  2Ni(OH)2+2Cd (OH)2?已知Ni(OH)2和Cd (OH)2均难溶于水但能溶于酸,以下说法中正确的是
2Ni(OH)2+2Cd (OH)2?已知Ni(OH)2和Cd (OH)2均难溶于水但能溶于酸,以下说法中正确的是
①以上反应是可逆反应? ②以上反应不是可逆反应
③充电时化学能转变为电能? ④放电时化学能转变为电能
A.①③
B.②④
C.①④
D.②③
2、选择题 用锌片、铜片和硝酸银组成的原电池,正极上发生的电极反应是
A.2H++2e-=H2↑
B.Zn-2e-=Zn2+
C.2H2O+O2+4e-=4OH-
D.Ag++e-=Ag
3、填空题 由等质量的Zn片、Cu片和稀H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。
(1)原电池的正极反应式是_______;
(2)反应中生成氢气的体积是_______;(标准状况);
(3)若将电解质溶液改为CuSO4溶液,也输出相同电量时,两极的质量差是_______。
4、选择题 据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是 H+。下列对该燃料电池的描述中正确的是
[? ]
①正极反应为:O2+4H++4e-=2H2O
②负极反应为:2H2 -4e-=4H+
③总的化学反应为:2H2+O2 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③
B.②③④
C.①②④
D.①②③④
5、填空题 (1)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示。

①电源正极为__________(填A或B),阴极反应式为________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
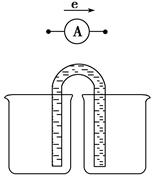
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是_________________________________________________________________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在所给的材料中应选__________作阳极。