1、填空题 现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A) ; (B) ;(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是 ; 电解质溶液是 。
②写出电极反应式:负极 ;正极 。
③若导线上转移电子1mol,则负极质量变化 g。
参考答案:(每空1分,共7分)
(1)(A)不能;(B)能 ;
(2)①铜片 ; FeCl3溶液 ②Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+ ③32
本题解析:(1)原电池中发生的是氧化还原反应,故(A)不能;(B)能。
(2)①负极和电解液发生反应时失去电子,化学价升高,发生氧化反应,故负极材料是铜片,电解液是FeCl3溶液。
②负极失去电子,电极式为Cu-2e-=Cu2+;正极得到电子,电极式为2Fe3++2e-=2Fe2+。
③根据电极式计算,若导线上转移电子1mol,则负极物质的量变化为0.5mol,质量为32g。
考点:原电池
点评:本题考查了以原电池原理设计原电池,难度较大,原电池的设计是学习的重点和难点,明确原电池的工作原理是设计原电池的关键。
本题难度:一般
2、选择题 X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y;X和Z在稀硫酸中构成原电池时,Z为正极;用石墨电极电解含Y和Z的离子的溶液时,阴极先析出Y;M的离子氧化性强于Y的离子,则这些金属的活动性由强到弱的顺序是( )
A.X、Y、Z、M
B.X、Z、M、Y
C.M、Z、X、Y
D.X、Z、Y、M
参考答案:较活泼金属能置换较不活泼的金属,X可以从Y的盐溶液中置换出Y,所以金属的活动性X>Y;
X和Z在稀硫酸中构成原电池时,Z为正极,所以金属的活动性X>Z;
若电解Y和Z离子共存的溶液时,Y先析出,说明Y离子氧化性强于Z离子,所以金属的活动性Z>Y,M离子的氧化性强于Y离子,所以金属的活动性Y>M,综上可知四种金属的活动性由强到弱的顺序为X>Z>Y>M.
故选D.
本题解析:
本题难度:简单
3、选择题 下列铜-锌原电池装置中,电极材料、灯泡、烧杯等均相同,能使小灯泡最亮用持续时间最长的是
参考答案:C
本题解析:原电池中两电极的距离越近,反应速率越快,即小灯泡最亮。另外重铬酸钾还具有强氧化性,也可以加快反应速率,所以正确的答案选C。
点评:该题是中等难度的试题,试题设计新颖,针对性强,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
4、填空题 剪约6 cm长、2 cm宽的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm)。 将铜片与铝片分别和电流表的“+”“-”端相连接, 电流表指针调到中间位置。取两个50 mL的小烧杯,在一个烧杯中注入约40 mL的浓硝酸,在另一只烧杯中注入40 mL 0.5mol·L-1的硫酸溶液。
试回答下列问题:
(1)两电极同时插入稀硫酸中,电流表指针偏向 ___(填“铝”或“铜”)极,铝片上电极反应式为____;
(2)两电极同时插入浓硝酸时,电流表指针偏向 ___(填“铝”或“铜”)极,此时铝是___ (填“正”或“负”)极,铝片上的电极反应式为___。
参考答案:(1)铝 ;Al-3e-=Al3+
(2)铜 ;正 ;2NO3-+ 4H++2e-=2NO2↑+2H2O
本题解析:
本题难度:一般
5、选择题 下面几种情况,哪些能够形成原电池
[? ]
A.
B.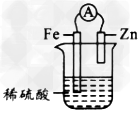
C.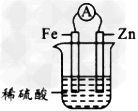
D.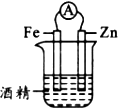
参考答案:C
本题解析:
本题难度:简单