1、选择题 下列排列顺序错误的是?(?)
A.酸性:H4SiO4﹤H3PO4﹤H2SO4﹤HClO4
B.氢化物的稳定性:CH4﹤NH3﹤H2O﹤HF
C.碱性:KOH﹥Ca(OH)2﹥Mg(OH)2
D.沸点:HI﹥HBr﹥HCl﹥HF
参考答案:D
本题解析:非金属性越强,最高价氧化物的水化物的酸性、氢化物的稳定性越强,所以选项AB正确;同样金属性越强,最高价氧化物的水化物的碱性越强,C正确;由于HF分子间存在氢键,则HF的沸点高于同主族元素氢化物的沸点,D不正确,答案选D。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
2、填空题 (12分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
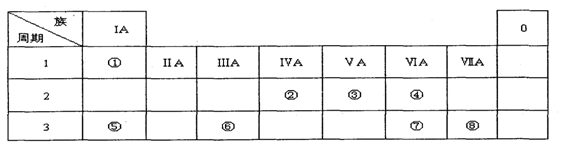
I.(1)请画出元素⑧的离子结构示意图?。
(2)元素⑦中质子数和中子数相等的同位素符号是?。
(3)④、⑤、⑦的原子半径由大到小的顺序为?。(用半径符号表示)
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为?>?。
II.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
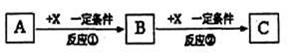
(1)若X是强氧性化单质,则A不可能是?(填序号)。
a.S? b.N2? c.C ? d.Al
(2)若A是饮食中的有机物,B与C分子量相差16则A与C反应的方程式:并指出反应类型
???
(3)若A,B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:??
参考答案:
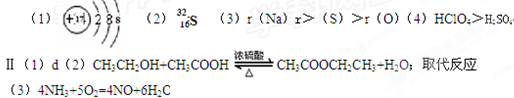
本题解析:略
本题难度:一般
3、选择题 下列物质中,各元素原子的最外层电子全部参加成键的是?(?)
A.氟化氢
B.水
C.硅化氢
D.二氧化碳
参考答案:C
本题解析:A项,氟化氢只有一对共用电子对,而氟元素周围还有三对孤对电子;B项,水有两对共用电子对,而氧元素周围有两对孤电子对;C项,硅化氢有四对共用电子对,硅元素和氢元素的原子的最外层电子全部参加成键,正确;D项,二氧化碳分子中形成两个双键,但氧元素周围还有两对孤对电子,错误。
本题难度:简单
4、填空题 (6分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大两个单位,C的质子数比B多4个,1 mol A的单质与酸反应,能置换出1 g H2,这时A转化为具有与氖原子相同的电子层结构的离子。则A的原子结构示意图为_______①________,B离子的核外电子排布式为________②________,C原子外围电子的轨道表示式为_________③_______。
参考答案:①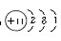 ②1s22s22p6?③
②1s22s22p6?③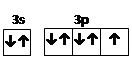
本题解析:1 mol A的单质与酸反应,能置换出1 g H2,时A转化为具有与氖原子相同的电子层结构的离子说明,A是一价金属,则A为Na,B为Al,C为Cl。所以A的原子结构示意图为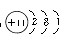 ,B离子的核外电子排布式为1s22s22p6,C原子外围电子的轨道表达式为
,B离子的核外电子排布式为1s22s22p6,C原子外围电子的轨道表达式为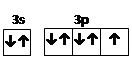 。
。
点评:本题非常简单,主要根据原子的结构特点进行推断。
本题难度:一般
5、选择题 某粒子含有6个电子,8个中子,电荷数为0,则它可以表示为
A.14Si
B.14Si
C.14C
D.14C
参考答案:C
本题解析:
分析:电荷数为0的微粒中核外电子数等于核内质子数,原子中核外电子数=核内质子数=原子序数,质子数+中子数=质量数,据此分析解答.
解:某粒子电荷数为0,则该微粒中核外电子数=核内质子数;某粒子含有6个电子,原子中核外电子数=核内质子数=原子序数=6,所以该元素是碳元素;该碳原子中质量数=质子数+中子数=6+8=14,所以该原子为14C.
故选C.
本题难度:一般