1、简答题 现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出).其中B是地壳中含量居第一的金属元素.请回答下列问题:

(1)写出金属B和气体丙的化学式______、______.
(2)写出反应①的化学反应方程式______.
(3)写出反应⑥的离子方程式______.
参考答案:有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,溶液D为氢氧化钠溶液,推断D为NaOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,气体丙为HCl,溶于水得到溶液E为盐酸溶液;溶液D和溶液G反应生成红褐色沉淀H判断H为Fe(OH)3,结合转化关系中的反应物性质,溶液G为FeCl3,溶液F为氯化亚铁溶液;推断出C为Fe;
(1)依据上述推断可知B为Al,丙为HCl,故答案为:Al;HCl;
(2)反应①是金属钠和水反应生成氢氧化钠和氢气的反应,反应的化学反应方程式:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)反应⑥是氢氧化钠和氯化铁反应生成氢氧化铁沉淀的反应,反应的离子方程:Fe3++3OH-=Fe(OH)3↓,故离子方程式为:Fe3++3OH-=Fe(OH)3↓;
本题解析:
本题难度:一般
2、填空题 如图是部分元素的单质和化合物之间的相互转化关系,部分反应的生成物没有全部列出.已知原料A、M均属于金属氧化物,L是由两种沉淀组成的.F和Y反应能生成一种全部为非金属元素所组成的盐,C的焰色反应呈黄色,M有磁性,反应①中B和C的物质的量之比为3:4.
回答下列问题:
(1)反应②的主要用途是:______(答一点即可,2分),Y的空间构型为______.
(2)已知反应③中还有一种无色气体生成,写出反应③的离子方程式:______.
(3)L中两种沉淀为______(用化学式表示),A的化学式为______.
(4)若将M溶于稀硫酸中可形成溶液Z,请设计简单的实验,证明Z溶液中所含的金属阳离子:______.

参考答案:F和Y反应能生成一种全部为非金属元素所组成的盐,所以生成的盐为铵盐,故F和Y有一种是酸,一种是氨气;M有磁性,所以M是四氧化三铁;H和B 反应生成四氧化三铁,所以H和B有一种是氧气,一种是铁;四氧化三铁能和F反应,四氧化三铁和酸反应,和氨气不反应,所以F是酸,Y是氨气;B和Y反应生成D,氨气和铁不反应,和氧气反应,所以B 是氧气,H是铁;A是氧化物,A和X反应生成氧气,所以A是过氧化钠;氧气和氨气反应生成一氧化氮,所以D是一氧化氮;一氧化氮和氧气反应生成二氧化氮,所以E是二氧化氮;二氧化氮和水反应生成硝酸和一氧化氮,F是酸,所以F 是硝酸,X是水;过氧化钠和水反应生成氢氧化钠和氧气,所以C是氢氧化钠;四氧化三铁和N生成铁的反应是铝热反应,所以N是铝,G是氧化铝;氧化铝和氢氧化钠反应生成偏铝酸钠和氢气,I和硝酸铁反应生成L,L有两种沉淀,所以I是偏铝酸钠,L是氢氧化铝和氢氧化铁.
(1)铝热反应的用途是冶炼金属或焊接钢轨;氨气分子的空间构型为三角锥型,
故答案为:冶炼金属或焊接钢轨;三角锥型;
(2)四氧化三铁和硝酸反应生成硝酸铁、一氧化氮和水,故答案为:3Fe3O4+28H++NO3-=9Fe3++NO+14H2O;
(3)通过以上分析知,L为Fe(OH)3、Al(OH)3,A为Na2O2,故答案为:Fe(OH)3、Al(OH)3;Na2O2;
(4)四氧化三铁和稀硫酸反应生成硫酸铁和硫酸亚铁、水,三价铁离子用硫氰化钾溶液检验;二价铁离子用酸性高锰酸钾溶液检验,
故答案为:分别取少量乙溶液于两支洁净的试管中,向第一支试管中滴加硫氰化钾溶液,溶液变血红色,证明有Fe3+,向第二只试管中,滴加少量酸性高锰酸钾溶液,振荡,高锰酸钾紫色褪去,证明含有Fe2+.
本题解析:
本题难度:一般
3、简答题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.请回答下列问题:
(1)E的电子式为______.
(2)反应③的离子方程式为______.
(3)F与G的溶液反应的化学方程式为______.
(4)检验溶液L中金属阳离子的方法是______.
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为______(此分子式中元素符号书写次序按从左往右元素原子序数“大小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为______.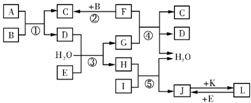
参考答案:C、D均能使澄清的石灰水变混浊,能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C、D属于二氧化碳和二氧化硫;E为单质,D、E均能使品红溶液褪色,能使品红溶液褪色的有氯气和二氧化硫,所以D是二氧化硫,C是二氧化碳,E是氯气;I是一种红棕色固体氧化物,I是氧化铁;B、F为单质,其中F为黑色固体,F和B反应生成二氧化碳,所以F是碳,B是氧气;A和氧气反应生成二氧化碳和二氧化硫,所以A是;氯气和水、二氧化硫反应生成硫酸和盐酸,碳和硫酸反应,所以G是硫酸,H是盐酸;盐酸和氧化铁反应生成氯化铁和水,所以J是氯化铁;K为单质,J和K反应生成L,L和氯气反应生成氯化铁,所以L是氯化亚铁,K是铁.
(1)E是氯气,E的电子式为:
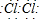
.
故答案为:
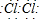
.
(2)氯气和二氧化硫、水反应生成硫酸和盐酸,离子反应方程式为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+.
故答案为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+
(3)碳和硫酸在加热条件下反应生成二氧化硫和二氧化碳、水,
反应方程式为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
(4)二价铁离子的检验方法是:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色就证明有二价铁离子存在.
故答案为:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色.
(5)气体A的密度为相同状况下氢气密度的30倍,所以A的相对分子量是氢气的30倍,即A的相对分子量为60,且A中含3种组成元素,通过以上分析A中一定含有硫和碳元素,且A和氧气反应后生成二氧化硫和二氧化碳,所以A含有氧元素,分子式为SCO;A分子中各原子均达8电子稳定结构,则其结构式为S=C=O.
故答案为:SCO;S=C=O.
本题解析:
本题难度:一般
4、简答题 X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)
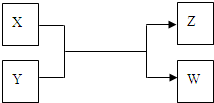
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是______.
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途______.
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是______.
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是______.
(2)若用下列装置只进行Z+W═X+Y反应(夹持装置未画出):

①完成此实验有多步操作,其中三步是:
a.点燃酒精灯
b.滴加盐酸
c.检验气体纯度
这三步操作的先后顺序是______(填字母).
②为保证实验成功,上述装置需要改进,方法是(用文字叙述)______.
(3)将3.48g?Z加入50mL?4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液______mL?(精确到0.1).
参考答案:Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
(1)通过以上分析知,X是氯气,为黄绿色气体,故答案为:黄绿色;
(2)工业上用电解饱和氯化钠溶液制取氢氧化钠,电解方程式为:2NaCl+2H2O??电解?.??H2↑+Cl2↑+2NaOH,
故答案为:2NaCl+2H2O??电解?.??H2↑+Cl2↑+2NaOH;
(3)氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+,
故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O?高温?.??Fe3O4+4H2,故答案为:3Fe+4H2O?高温?.??Fe3O4+4H2;
(2)①氢气还原氧化物的实验中,因为氢气和氧气在一定范围内会产生爆炸,所以实验应该先制取氢气,然后检验氢气再通入氢气,通入一段时间后再点燃酒精灯,所以实验顺序为b、c、a,故答案为:b?c?a;
②该反应是放热反应,盐酸检验挥发性,所以制取的氢气中含有氯化氢气体,为防止氯化氢气体干扰实验,应该在甲、乙装置中间增加一个装有水的洗气瓶,洗气氯化氢气体,
故答案为:在甲、乙装置中间增加一个装有水的洗气瓶;?
(3)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
硝酸的物质的量=4mol/L×0.05L=0.2mol,充分反应,产生112mL的NO,根据氮原子守恒,硝酸和一氧化氮的物质的量之比为1:1,则溶液中剩余硝酸的物质的量=0.2mol-0.112L22.4L/mol=0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V.
NaOH------NO3-,
1mol? 1mol
2V?0.195mol
V=97.5mL,
故答案为:97.5.
本题解析:
本题难度:一般
5、简答题 V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如图1所示:
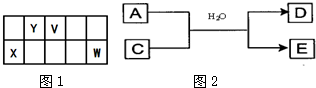
V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:
(1)W的原子结构示意图为______;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成.其反应的化学方式______;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如图2的反应关系:若E为白色沉淀,则E物质的化学式为______;
(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素分别沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp〔X(OH)n〕______(填“>”或“<”)ksp〔Z(OH)n〕;
(5)联氨(N2H4)也叫做肼,是重要的火箭燃料.以次氯酸钠溶液氧化M,能获得肼的稀溶液.其反应的离子方程式为______.同温同压下,将?a?L?M气体和b?L?N气体通入水中,若所得溶液的pH=7,则a______b(填“>”或“<”或“=”).
参考答案:V、W的最简单气态氢化物M、N混合时有白烟生成,应为NH4Cl,M能使湿润的pH试纸变蓝,应为NH3,则N为HCl,所以V为N元素,W为Cl元素,根据四种元素在周期表中的位置可知X为Al元素,Y为C元素,Z是人体血红蛋白中存在的金属元素,应为Fe元素,则
(1)W为Cl元素,原子核外有3个电子层,最外层电子数为7,则原子结构示意图为
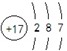
,故答案为:
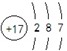
;?
(2)二氧化钛(TiO2)与Al的单质、C的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成,应为Al2O3和TiC,则反应的化学方程式为
4Al+3TiO2+3C?高温?.??2Al2O3+3TiC,故答案为:4Al+3TiO2+3C?高温?.??2Al2O3+3TiC;?
(3)含Al的化合物与CO2在水溶液中发生反应生成白色沉淀,应为AlO2-和CO2的反应,生成沉淀为Al(OH)3,故答案为:Al(OH)3;
(4)X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Z(OH)n先生成沉淀,则说明ksp〔X(OH)n〕>ksp〔Z(OH)n〕,
ksp越小的物质,越易生成沉淀,故答案为:>;
(5)次氯酸钠溶液氧化NH3,能获得肼的稀溶液,反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,如果等物质的量混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,若所得溶液的pH=7,则NH3应过量,即a>b,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;>.
本题解析:
本题难度:一般