?
参考答案:
(1) Na2SO3+H2O
(2) Na2SO3
(3) ①SO32-、ClO-都存在
②
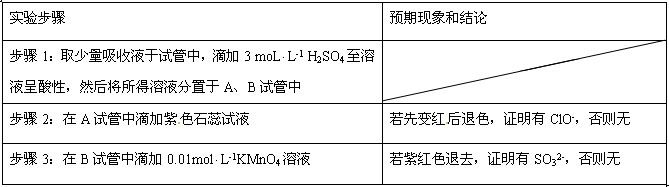
本题解析:略
本题难度:简单
2、填空题 室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3—种沉淀;
假设二:这两者祁互促进水解,生成Cu(OH)2—种沉淀,则此反应化学方程式为:____________________________;
假设三:生成的是CuCO3和Cu(OH)2两种沉淀。
(二)【理论探究】
查阅资料:CuCO3, Cu(OH)2均不带结晶水; Cu(OH)2均不带结晶水;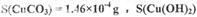 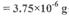 ;若由此数据判断,假设_______是不正确的。 ;若由此数据判断,假设_______是不正确的。
(三)[实验探究]
步滋一:将CuCO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②_______,③干燥。
步骤三:利用下图所示装置,进行定量分析:
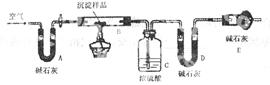
①仪器组装好后首先要进行的实验操作是_____________________。
②实验结束时通入过量空气的作用是_____________________。
③数据记录和分析:实验过程中测定的数据有:W1——样品的质量;W2——反应后装置B中残渣的质量;W3——反应生成的水的质量;W4——反应后生成二氧化碳的质量,为了测定其组成,至少需要其中? 个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)
参考答案:(一)假设二:Na2CO3 +CuSO4 +H2O=Cu(OH)2↓+Na2SO4+CO2↑(3分)
(二)一 (2分)
(三) 步骤二:洗涤(1分)
步骤三:①检查装置的气密性 (2分)
②保证装置中的水蒸气和CO2被C、D装置完全吸收(2分。只要涵义表达清楚即给2分)
③2(2分)
W1W2
W1W3
W1W4
W2W3
W2W4
W3W4
?
?
(每答对2组给1分,不存在0.5分,共3分)
本题解析:略
本题难度:一般
3、实验题 (14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
第一组
实验装置

实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称?,D中盛放的试剂是?。
(2)B中发生反应的化学方程式为?。
(3)A中反应的离子方程式为?。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是?(选填字母)
A.实验后期不通入空气? B.将仪器C中的硫酸换成盐酸
C.撤走仪器D? D.撤走仪器F
第二组
实验装置
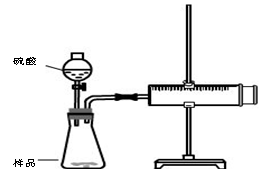
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
检查该装置气密性的方法是:?。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为?(填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为?。
参考答案:第一组
(1)分液漏斗(1分),浓硫酸(1分)?(2)Na2CO3+H2SO4=Na2SO4+CO2↑+H2O? (2分)
(3)CO2+2OH-=CO32-+H2O? (2分)?(4)A? (2分)
第二组
(1)连接好装置,关闭分液漏斗的活塞,将注射器的活塞向外拉一段距离,松开活塞后,若活塞最终回到原来的位置,即证明气密性良好,否则气密性不好。(2分)
(2)观点二(2分)? (3)53%(2分)
本题解析:第一组实验:仪器C为分液漏斗,它的构造区别于普通漏斗,普通漏斗没有活塞,也没有瓶塞,而分液漏斗有。将稀硫酸加入样品后,稀硫酸酸会与样品中的碳酸钠发生复分解反应,其化学反应方程式为:H2SO4 + Na2CO3===== Na2SO4 + CO2↑+ H2O,从装置B中出来的CO2气体中含有水蒸气,为了防止水蒸气被E装置中的碱石灰吸收而造成样品中Na2CO3的质量百分含量偏高,D装置要用盛有浓H2SO4的洗气瓶除去CO2气体中含有水蒸气。为了防止空气中的CO2气体和水蒸气进入E装置而造成样品中Na2CO3的质量百分含量偏高,所以,还需要在装置的最后面连一个盛有碱石灰的球形干燥管。
反应结束后,为了使生成的CO2气体充分被E装置中的碱石灰吸收,需要从A装置中缓缓通入空气,使装置中残留的CO2气体全部被E装置中的碱石灰吸收。由于空气中也含有一定的CO2气体,为了防止空气中的CO2被E装置中的碱石灰吸收,所以,在A装置中加入氢氧化钠溶液,除去空气中的CO2气体,离子方程式为:CO2+2OH-=CO32-+H2O。当然,稀硫酸不能用盐酸代替,因为盐酸会挥发出HCL气体,也会被碱石灰吸收,从而造成Na2CO3的质量百分量偏高。综上所述,第一组实验的正确答案为:
第一组
(1)分液漏斗(1分),浓硫酸(1分)?(2)Na2CO3+H2SO4=Na2SO4+CO2↑+H2O? (2分)
(3)CO2+2OH-=CO32-+H2O? (2分)?(4)A? (2分)
第二组实验解析:(1)连接好装置,关闭分液漏斗的活塞,将注射器的活塞向外拉一段距离,松开活塞后,若活塞最终回到原来的位置,即证明气密性良好,否则气密性不好。
(2)当加入20mL硫酸后,空气也会被挤入注射器中,所以观点二正确。
(3)标准状况下,根据气体的体积76mL可求得气体的物质的量,进而可求得样品中碳酸钠的质量百分含量为53%
本题难度:一般
4、选择题 某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是
[? ]
①假说法 ②实验法 ③分类法 ④比较法
A.①②
B.①③
C.②④
D.①③
参考答案:C
本题解析:
本题难度:简单
5、选择题 向某溶液中加BaCl2溶液,产生白色沉淀,加稀HNO3沉淀不消失,则溶液中(?)
A.一定含有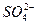 、Ag+中的一种或几种 、Ag+中的一种或几种
B.一定含有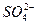 或Ag+,不含 或Ag+,不含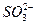
C.一定含有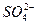 或 或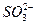 或Ag+ 或Ag+
D.一定含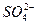 、 、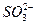 、Ag+中的一种或几种 、Ag+中的一种或几种
参考答案:D
本题解析:BaCl2中含有Ba2+与Cl-。加入某溶液后出现不溶于稀HNO3的沉淀,故沉淀应为BaSO4或AgCl。故溶液可能含有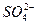 或Ag+,另因HNO3有强氧化性,可能会将 或Ag+,另因HNO3有强氧化性,可能会将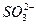 氧化为 氧化为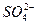 而生成BaSO4,故其中也可能有 而生成BaSO4,故其中也可能有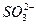 。 。
本题难度:简单
|