1、实验题 (10分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用右图所示装置进行有关实验。
请回答:
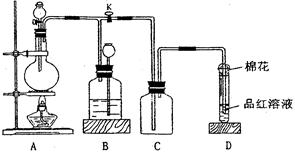
(1) 装置A中发生的化学反应方程式为
_____________________________________。
(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是 ?,其作用是 ?。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是?。
B中应放置的液体是(填字母) ?。
a.水? b.酸性KMnO4溶液? c.浓溴水? d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是?。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.NaOH固体? b.BaCl2溶液? c.银粉? d.Na2CO3溶液
参考答案:(10分)(1)Cu+2H2SO4(浓)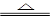 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)碱液(其他合理答案均可给分);?吸收多余的二氧化硫,防止污染空气
(3)广口瓶中液面下降,而长颈漏斗中液面上升;? d
(4)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应?②d
本题解析:(1)本题探究铜跟浓硫酸的反应情况,由图可知,A为反应的发生装置,即铜与浓硫酸在加热的条件下发生反应;
(2)装置D中试管口放置的棉花中应浸有可以吸收多余SO2的碱液,目的是防止污染空气;
(3)装置B的作用是贮存多余的气体,B中应放置饱和NaHSO3溶液,故而B中现象是广口瓶中液面下降,而长颈漏斗中液面上升;
(4)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,故而不能反应完全,②用来检验是否还有硫酸,a.加入NaOH固体观察不到现象, b.加入BaCl2溶液只能证明硫酸根离子的存在,c.加入银粉不反应,d.加入Na2CO3溶液有气泡产生,现象明显,故选d
点评:本题考查铜与浓硫酸的反应,注意积累实验基础知识和环保理念,本题难度不大。
本题难度:一般
2、实验题 (16分)某同学为了研究乙酸的性质,进行了如下实验:
(一)该同学利用下图所示的仪器和药品,设计了一个简单的一次性完成实验装置,来验证乙酸、碳酸和苯酚溶液酸性强弱。
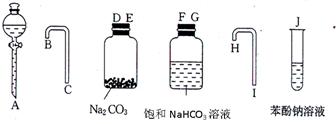
(1)实验装置的连接顺序是:A→?→?→?→ C →?→?→?→?→J
(2)写出实验中能说明碳酸比苯酚的酸性强的化学方程式 ?。
(二)为了研究乙酸的酯化反应,该同学进行了如下实验,步骤如下:在 园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装
园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装 通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)反应中浓硫酸做__________剂和吸水剂(或脱水剂)。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_________________。
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。若需要在图中圆括号内填入适当试剂,在方括号内填入适当分离方法。
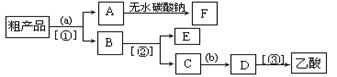 ?
?
下列试剂和分离方法正确的是 ?。
?。
A.试剂a是氢氧化钠溶液,试剂b是稀硫酸;分离方法①是蒸馏,分离方法②是分液,分离方法③是蒸馏
B.试剂a是饱和碳酸钠溶液,试剂b是稀硫酸;分离方法①是分液,分离方法②是蒸馏,分离方法③是蒸馏
C.试剂a是饱和碳酸钠溶液,试剂b是稀硝酸;分离方法①是过滤,分离方法②是分液,分离方法③是蒸馏
D.试剂a是氢氧化钠溶液,试剂b是盐酸;分离方法①是 分液,分离方法②是蒸馏,分离方法③是分液
分液,分离方法②是蒸馏,分离方法③是分液
(4)该同学在查阅资料时发现 ,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:
,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:

a.你认为其中属于加成反应的是?(填反应序号,在①②③④中选取)
b.在有机羧酸和醇的酯化反应中,脱水时,羧酸脱 ?基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是?。
?基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是?。
A.18O只能标记在醇羟基上
B. 18O只能标记在羧酸的羟基上
C.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上
D.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上,还可以标记在羧酸的羰基
上
参考答案:(一)(1)A→ D?→? E?→? B?→ C →? F → G?→? H →? I →J
(2分,错一个就记0分)
(2)CO2+H2O+C6H5ONa → C6H5OH+NaHCO3?(2分)
(二)(1)催化剂(2分)?(2)及时地蒸出生成物,有利于酯化反应向生成酯的方
向进行(2分)?(3)B (2分)(4)a.①④?(2分)? b.羟(2分)
A?(2分)
本题解析:略
本题难度:简单
3、选择题 下列不符合当今化学研究方向的是
[? ]
A.发现新物质
B.合成新材料
C.研究化学反应的微观过程
D.研究化学反应中原子守恒关系
参考答案:D
本题解析:
本题难度:简单
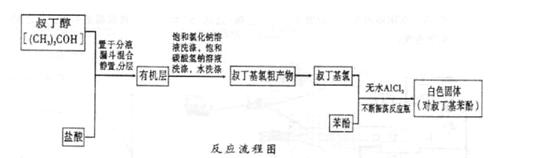
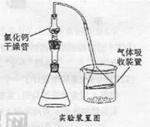
4、实验题 Fridel—Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:Ar+RX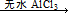 ArR+HX?△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
ArR+HX?△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
试回答下列问题:
(1)实验装置烧杯中漏斗的作用是________。
(2)巳知Fridel—Cxafts反应是放热反应,为防止叔丁基氣的蒸气被大量的HCl气体带走而影响产率,应将锥形瓶置于_______(填“冷水浴”或“热水浴”)中。
(3)有机层中加入饱和氣化钠溶液及饱和碳酸氢钠溶液的作用可能是_______。通过?操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(4)某同学因去掉该制备装置中的氣化钙干燥管,发现产率很低(观察不到对叔丁基苯酚白色固体)且锥形瓶中有大量的白雾,他推测是作催化剂的AlCl3发生强烈水解所致,该同学设计如下实验方案进行验证,请完成下表内容。
实验方案
| 实验现象
| 能否说明水解
|
①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液
| ?
| ?
|
②将充分冒白雾后的液体抽滤,得不溶性固体,将固体分成两份,?
?。
| 两份固体均溶解
| ?
|
?
(5)若上述同学称取了9.4g苯酚与适量叔丁基氯反应,从反应液中提取出对叔丁基苯酚,将其配成100mL乙醇溶液,移取25.00mL溶液,滴定,消耗NaOH物质的量为5×10-4moL,则以苯酚为基准计算对叔丁基苯酚产率的表达式为_______。
参考答案:(16分)
(1)防止液体倒吸(2分)
(2)冷水浴(2分)
(3)除去叔丁基氯粗产物中的HCl(3分)?蒸馏(2分)
(4)(4分)
实验方案
实验现象
能否说明水解
①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液
产生白色沉淀(1分)
不能(1分)
②将充分冒白雾后的液体抽滤,得不溶性固体,将固体分成两份,一份加入足量的盐酸,另一份加入足量的NaOH溶液,振荡。(1分)
两份固体均溶解
?能(1分)
?
(5)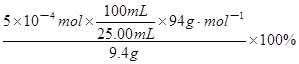 (3分)
(3分)
本题解析:(1)依题意,叔丁醇与过量的盐酸发生取代反应,生成叔丁基氯和水,由于叔丁醇、叔丁基氯和水的沸点分别为90.7℃、50.7℃、100℃,则反应后从锥形瓶、干燥管逸出的气体是盐酸挥发出的HCl气体,由于HCl易溶于水,所以烧杯中倒扣漏斗的作用是防止液体倒吸;(2)叔丁基氯的沸点为50.7℃,因此应将锥形瓶置于冷水浴中,可以防止叔丁基氯沸腾;(3)HCl的酸性比碳酸强,HCl的溶解度比NaCl大,由此推断加入饱和氯化钠溶液及饱和碳酸氢钠溶液的作用是除去叔丁基氯粗产物中的HCl;由于叔丁醇、叔丁基氯的沸点分别为90.7℃、50.7℃,相差40℃,因此通过蒸馏可以从叔丁基氯粗产物中分离提纯出叔丁基氯;(4)叔丁基氯与苯酚发生Fridel—Crafts反应,生成对叔丁基苯酚和HCl,由于观察不到对叔丁基苯酚白色固体,则锥形瓶中白雾可能是无水AlCl3,也可能是AlCl3发生强烈水解产生的盐酸,因此将白雾通入HNO3酸化的AgNO3溶液,产生白色沉淀,只能说明白雾中存在Cl-,不能证明AlCl3水解;由于AlCl3水解产物是氢氧化铝和HCl,氢氧化铝难溶于水,HCl易溶于水,将充分冒白雾后的液体抽滤,得到的不溶性固体为Al(OH)3,Al(OH)3是两性氢氧化物,既能溶于强酸,又能溶于强碱,所以向一份固体中加入足量盐酸,向另一份固体中加入足量NaOH溶液,若两份固体均溶解,能说明AlCl3水解;(5)由于1mol对叔丁基苯酚与1molNaOH恰好完全中和,由滴定时消耗NaOH物质的量推断25.00mL溶液中含对叔丁基苯酚的物质的量为5×10-4moL;由于100mL溶液是25.00mL溶液的4倍,则100mL溶液中含对叔丁基苯酚的物质的量为5×10-4moL×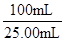 ;由于1mol苯酚与1mol对叔丁基苯氯完全反应时,生成1mol对叔丁基苯酚1molHCl,根据对叔丁基苯酚的物质的量推断参加反应的苯酚的物质的量为5×10-4moL×
;由于1mol苯酚与1mol对叔丁基苯氯完全反应时,生成1mol对叔丁基苯酚1molHCl,根据对叔丁基苯酚的物质的量推断参加反应的苯酚的物质的量为5×10-4moL×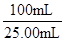 ;苯酚的分子式为C6H6O,则相对分子质量为94,由于m=n?M,则参加反应的苯酚质量为5×10-4moL×
;苯酚的分子式为C6H6O,则相对分子质量为94,由于m=n?M,则参加反应的苯酚质量为5×10-4moL×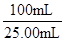 ×94g?mol-1;由于苯酚的实际质量为9.4g,则参加反应的苯酚质量分数表达式(或以苯酚为基准计算对叔丁基苯酚产率的表达式)为
×94g?mol-1;由于苯酚的实际质量为9.4g,则参加反应的苯酚质量分数表达式(或以苯酚为基准计算对叔丁基苯酚产率的表达式)为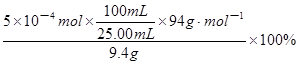 ≈2.0%。
≈2.0%。
本题难度:一般
5、选择题 在酸性条件下H2C2O4可以被KMnO4溶液氧化,使KMnO4溶液褪色,依据KMnO4溶液褪色时间的长短可以比较反应进行的快慢。下列各组实验中溶液褪色最快的是
组号
| 反应温度
/℃
| 参加反应物质
|
KMnO4
| H2C2O4
| MnSO4
|
V/mL
| c/mol·L-1
| V/mL
| c/mol·L-1
| m/g
|
A
| 20
| 4
| 0.1
| 2
| 0.1
| 0
|
B
| 20
| 4
| 0.1
| 2
| 0.1
| 0.1
|
C
| 40
| 4
| 0.1
| 2
| 0.1
| 0
|
D
| 40
| 4
| 0.1
| 2
| 0.2
| 0.1
参考答案:D
本题解析:
本题难度:简单
|