|
高考化学知识点归纳《探究性实验的设计与评价》高频试题巩固(2019年最新版)(六)
2019-05-30 04:39:46
【 大 中 小】
|
1、填空题 (15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
| (2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
实验
| 酸或碱
| 现象
| A
| 1滴0.2mol/LNaOH溶液
| 不变色
| B
| 1滴水
| 缓慢变浅棕褐色
| C
| 1滴0.1mol/L硫酸溶液
| 迅速变棕褐色
|
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 ?。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。
。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是?(填序号)。
 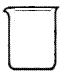  
A? ? B? C? D
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为? ?。
参考答案:
(1)A?(2分)
(2)酸性越强,MnO2氧化性越强?(2分)?
MnO2 + 2I- + 4H+=Mn2-+I2 + 2H2O?(3分)
(3)10.0?烧杯?(各1分,共2分)
(4)取5mL3%的H2O2溶液于试管中,滴入1滴碘水,观察是否有大量气泡产生,若有说明假设正确;反之假设不正确。?(2分)
(5)A D?(1分)
(6)2MnO2+2NH4++ 2e—= Mn2O3+2NH3+H2O?(3分)
本题解析:略
本题难度:一般
2、实验题 (12分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:
①该反应的气体产物是CO2;
②该反应的气体产物是CO;
③该反应的气体产物是?。
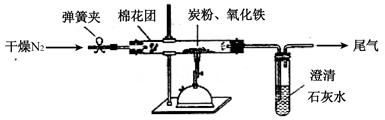
(2)计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:?。
(4)实验步骤:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为?。
(5)数据处理:
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
?。
(6)实验优化:
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是?。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
?。
参考答案:⑴CO2、CO的混合物
⑶NH4++NO2—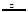 N2↑+2H2O N2↑+2H2O
⑷步骤②中是为了排除空气中的CO2,步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3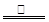 2Fe+CO↑+CO2↑ 2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
本题解析:(1)根据极端假设可知还有一种情况就是两者的混合物,即CO2、CO的混合物。
(3)用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液制氮气反应的离子方程式为:NH4++NO2—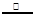 N2↑+2H2O。 N2↑+2H2O。
(4)步骤②通入氮气的目的是排除装置中的CO2。步骤④通入氮气的目的是将生成的CO2全部通入澄清石灰水中。
(5)由题意可知碳粉过量,产生的CO2为0.02mol,剩余的固体为3.76g,所以固体中有单质铁2.24g,则剩余的碳粉为3.76-2.24=1.52g,所以参加反应的碳粉为2-1.52=0.48g=0.04mol,则可以确定生成CO为0.02mol,因此方程式为:2C+Fe2O3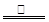 2Fe+CO↑+CO2↑。 2Fe+CO↑+CO2↑。
(6)①应将澄清石灰水换成Ba(OH)2溶液的原因是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全,M (BaCO3)>M(CaCO3),称量时相对误差小。②从环保的角度来看生成的CO也要处理掉,因此应该在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
点评:本题综合性较强,难度较大,主要考查学生分析问题和解决问题的能力。
本题难度:一般
3、选择题 下列关于研究物质性质的基本程序,排列顺序正确是( )
a、观察物质的外观b、实验和观察c、解释及结论d、预测物质的性质.
A.bacd
B.adbc
C.abcd
D.dabc
参考答案:B
本题解析:
本题难度:一般
4、填空题 开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是______(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是______(填字母).
a.电解水制氢:2H2O 2H2↑+O2↑
b.高温使水分解制氢:2H2O2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O2H2↑+O2↑
d.天然气制氢:CH4+H2OCO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4MnFe2O4-X+O2,则第二步反应的化学方程式为______(条件不写).
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
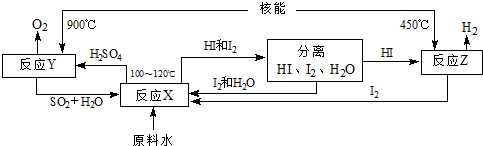
反应X的化学方程式为______,该流程中循环使用的原料有______.从理论上讲,该流程中,1mol原料水制得______molH2.
参考答案:(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故选bcd.
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
本题解析:
本题难度:一般
5、实验题 (12分)为探究如何尽可能多的使NO2被水吸收,某活动小组设计并完成了以下实验。
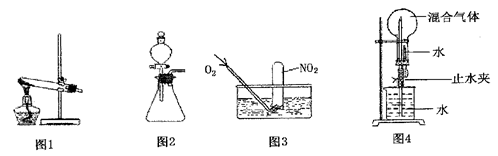
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置?(填“图l”或“图2”)分别制取NO2和O2。
②写出铜与浓硝酸反应的离子方程式?。
③写出过氧化氢溶液与MnO2制取O2时的化学方程式?。
④收集NO2的方法是?。
(2)活动小组的同学做了如下准备工作:用气囊收集好纯净的O2,收集了一试管NO2,用干燥的烧瓶收集了一定比例的NO2和O2的混合气体。
①为了尽可能多的使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通入O2相比,其优点是:
?。
②利用图4吸收气体时,其操作和现象为:
?。
③若图4中混合气体NO2和O2全部被吸收时所得溶液物质的量浓度为?mol/L(保留两位有效数字)。
参考答案:(12分)
(1)①图2(1分)
②Cu+4H++2NO3-=Cu2++2NO2↑+2H2O(2分)
③2H2O2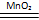 2H2O+O2↑(2分) 2H2O+O2↑(2分)
④瓶口向上排空气法(1分)
(2)①有利于控制氧气气流的速度(控制氧气的量)(2分)
②将胶头滴管中的水挤压进烧瓶,然后打开止水夹,可以看到烧杯中的水进入烧瓶形成喷泉(2分)
③0.036(2分)
本题解析:考查氮的氧化物的性质
(1)①两反应过程均为固液不加热,故一般选用图2作为气体的发生装置;
②Cu+4H++2NO3-=Cu2++2NO2↑+2H2O(2分)
③MnO2起催化作用:2H2O2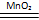 2H2O+O2↑(2分) 2H2O+O2↑(2分)
④NO2密度大于空气且可与水反应,故一般采用向上排空气法收集(1分)
(2)①直接制取O2气体,更有利于控制气体的用量及比例,更好的切合实验目的
②这是一套喷泉实验装置,挤压胶头滴管内的水,内部气压减小,打开止水夹,烧杯中的水即可进入烧瓶
③气体全部被吸收时,发生反应为:4NO2+O2+2H2O=4HNO3,设烧瓶的容积为VL
硝酸的物质的量为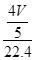 mol,所得硝酸溶液的浓度为 mol,所得硝酸溶液的浓度为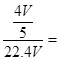 0.036mol/L 0.036mol/L
本题难度:一般
| 



