1、选择题 高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M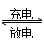 NiOOH+MH,下列叙述正确的是
NiOOH+MH,下列叙述正确的是
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e-===MH+OH-
C.放电时阳极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化
2、填空题 将质量相等的锌片和铜片用导线相连浸入500mL?硫酸铜溶液中构成如下图的装置.(1)此装置为______,该装置中发生反应总的离子方程式为______,铜片周围溶液会出现______的现象.
(2)若2min后测得锌片质量减少1.3g,则导线中流过的电子为______mo1.
(3)该装置的电解质溶液还可以用______?(答一种即可).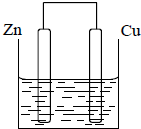
3、选择题 表明金属甲比金属乙活动性强的叙述正确的是
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子;甲比乙氧化性强
C.常温下甲能与浓HNO3反应而乙不能
D.将甲、乙组成原电池时,甲为负极
4、选择题 关于实现下列物品用途的主要物质的说法,不正确的是( )
| ?选项 | ?A | ?B | ?C | ?D
?物品
?

?

?

?

?用途
?化学能转化为电能
?吸附水分
?去除油污
光能转化为电能?
?主要物质
H2?SO4(aq)是电解质溶液
?硅酸干凝胶是主要成分
?硬脂酸钠是主要成分
?SiO2是转换材料
|
A.A
B.B
C.C
D.D
5、选择题 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是( )
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验④说明该原电池中铜为正极、锌为负极