| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡》答题技巧(2019年最新版)(八)
参考答案:B 本题解析:A.任何可逆反应都是在一定条件下进行的,最终会达到平衡状态,即达到了该反应的限度,正确;B.化学反应的限度是在一定条件下,若条件发生改变,限度就被破坏,就会建立新的条件下的新的限度,因此是可改变的,错误;C.相同条件下,不同的可逆反应,其反应的限度不同,正确;D.化学反应达到限度时,用任何一种物质表示的正逆反应速率相等,正确。 本题难度:一般 2、选择题 在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为 |
参考答案:C
本题解析:反应 N2(g)+3H2(g) NH3(g)的前后气体系数不同,所以若恒温恒容,反应要达到等效平衡,必须充入等量的N2和H2 ,所以充入2.0 molN2和6.0molH2 不能达到等效平衡,而是相当于加压,平衡右移,转化率升高生成更多NH3 ,故n(NH3)>1.2mol,;若保持恒温恒压,反应要达到等效平衡,则应该充入的N2和H2 应和原来的比例相同即n(N2):n(H2)= 1:3,所以充入2.0 molN2和6.0molH2满足等比例,可以达到等效平衡,故n(NH3)=1.2mol,所以综上所述应该选择C。
NH3(g)的前后气体系数不同,所以若恒温恒容,反应要达到等效平衡,必须充入等量的N2和H2 ,所以充入2.0 molN2和6.0molH2 不能达到等效平衡,而是相当于加压,平衡右移,转化率升高生成更多NH3 ,故n(NH3)>1.2mol,;若保持恒温恒压,反应要达到等效平衡,则应该充入的N2和H2 应和原来的比例相同即n(N2):n(H2)= 1:3,所以充入2.0 molN2和6.0molH2满足等比例,可以达到等效平衡,故n(NH3)=1.2mol,所以综上所述应该选择C。
考点:本题考查的是等效平衡的两种情况。
本题难度:一般
3、选择题 t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为: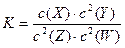 ,有关该平衡体系的说法正确的是 ( )
,有关该平衡体系的说法正确的是 ( )
A.升高温度,平衡常数K一定增大
B.增大压强,W(g)质量分数增加
C.该反应的化学反应方程式为X+2Y 2Z+2W
2Z+2W
D.增大X(g)浓度,平衡向逆反应方向移动
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列叙述正确的是
A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>②
C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小
D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存
参考答案:A
本题解析:A、增大体系压强,I2的浓度增大,体系颜色加深但方程式两边气体分子数相同,平衡不移动,错误;B、NaOH是强碱,而CH3COONa、Na2CO3水解使溶液呈碱性,且越弱越水解,NaNO3是强酸强碱盐溶液定为中性,pH的大小顺序是④>③>①>②,正确;C、氨水加水稀释后,NH3?H20的电离程度增大,c(OH-)减小,c(H+)增大,错误;D、c(H+)/(OH-)=10-10,溶液呈碱性,Al3+不能存在,故错误。
本题难度:一般
5、选择题 下列装置图或曲线图与对应的叙述相符的是(? )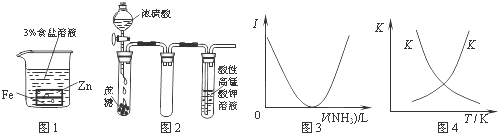
A.图1:负极反应是Fe-2e-═Fe2+
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I)的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g),△H<0”的平衡常数K正、K逆随温度的变化
参考答案:D
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《化学平衡的.. | |