1、填空题 对于可逆反应:2A(g)+3B(g) 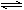 xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应开始到达平衡的时间是2 min,C的反应速率为0.5mol·L-1·min-1,平衡时D的浓度为0.5mol·L-1。求:
xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应开始到达平衡的时间是2 min,C的反应速率为0.5mol·L-1·min-1,平衡时D的浓度为0.5mol·L-1。求:
(1)x=
(2)B的平衡浓度为
(3)该反应平衡常数为 。(只要求写数值且保留一位有效数字)
参考答案:21. (1) 2 (2) 1.5 mol?L-1 (3)0.009
本题解析:解:依据化学平衡三段式列式计算
2A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L)4 1.5 0.5x 0.5
(1)C的反应速率为0.5x/2=0.5mol/(L?min),解得x=2,答案为:2;
(2)依据上述计算可知,2min末时,B的浓度=1.5mol/L,答案为:1.5mol/L;
(3)化学平衡常数K=0.5Х12/(1.5)3Х42=0.009
考点:考查化学平衡的计算。
本题难度:困难
2、填空题 下表是元素周期表的一部分:
族
| I A
| II A
| III A
| IV A
| V A
| VI A
| VII A
|
2
| ②
| ③
| ④
|
| ⑤
| ⑥
|
|
3
| ⑦
| ⑧
| ⑨
|
| ⑩
| 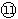
| 
|
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素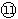 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: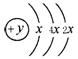 ,在周期表位于 。该
,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示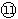 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与 。
。
参考答案:(1)PH3;强;弱
(2)第三周期第ⅣA族; 高 。
(3)(4)略。
本题解析:略
本题难度:简单
3、填空题 CH3OH(g)+H2O(g)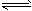 CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题
(1)在其它条件不变的情况下降低温度,则逆反应速率__________(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率__________。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为__________。
(3)判断该可逆反应达到平衡状态的依据是(填序号)__________。
A.v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是
____________(填序号)。
A.升高温度
B.降低温度
C.增大压强
参考答案:(1)减小;增大
(2)0.01mol/(L·s)
(3)CD
(4)BC
本题解析:
本题难度:一般
4、计算题 I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
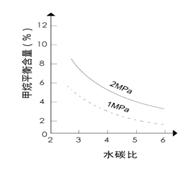
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
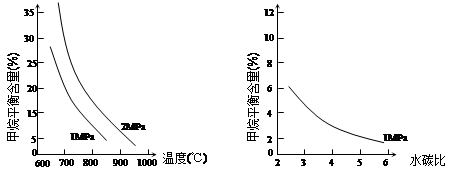
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。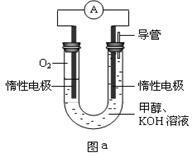
参考答案:(16分)
I.2ΔH1-2ΔH2+ΔH3(3分)
II.(1)其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动。(或描述降温的变化,3分)
(2)如下图(2分)(形状1分,标注1分)
(3)计算过程为:(格式2分,速率1分,常数2分,共5分)
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L)0.8 0.8 0.8 2.4
平衡浓度(mol/L)0.2 0.2 0.8 2.4

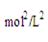
(平衡常数没写单位不扣分)
III.O2 + 2H2O + 4e-=4OH-(3分)
本题解析:I.先将4个热化学方程式依次编号为①②③④,再观察、比较后可得:①×2—②×2+③=④,由盖斯定律可知,④的焓变=①的焓变×2—②的焓变×2+③的焓变=2ΔH1-2ΔH2+ΔH3;II.(1)先读图1,发现在1Mpa或2Mpa、600℃~1000℃时,随着温度的升高,甲烷平衡含量均逐渐减小,说明平衡向正反应方向移动;再根据温度对化学反应速率和化学平衡的影响规律,当其他条件不变时,升高温度,反应速率加快,平衡向吸热反应方向或正反应方向移动,则甲烷蒸气转化为氢气的正反应是吸热反应;(2)画图要点:①甲烷蒸气转化为氢气的正反应是气体体积增大的反应,当温度和水碳比保持不变时,增大压强,平衡向气体体积减小方向或逆反应方向移动,则甲烷平衡含量增大,因此2MPa时甲烷平衡含量与水碳比之间关系曲线一定高于1MPa时甲烷平衡含量与水碳比之间关系曲线;②当温度和压强保持不变时,随着水碳比的增大,甲烷平衡含量逐渐减小;(3)依题意可知该可逆反应中各组分起始、变化、平衡浓度,则:
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 2.4
平衡浓度(mol/L) 0.2 0.2 0.8 2.4
根据平均反应速率的定义式,v(H2)=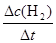 =
=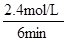 =0.4mol/(L?min)
=0.4mol/(L?min)
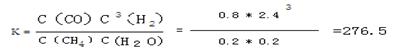
根据化学平衡常数的定义式,K=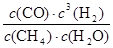 =
=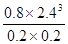 mol2/L2≈276.5 mol2/L2
mol2/L2≈276.5 mol2/L2
III.甲醇燃料电池中正极的主要反应物为氧气,氧元素由0降为—2价,则1个氧气分子得到4个电子,在KOH溶液中只能用氢氧根离子使反应物和产物的电荷守恒,则O2+4e-→4OH-;左边比右边少4个H、2个O原子,根据氢、氧原子个数守恒可知反应物中还有2H2O,则正极反应式为O2 +4e-+2H2O =4OH-。
考点:考查化学反应原理,涉及根据盖斯定律求焓变、根据化学平衡图像得出温度对反应速率和平衡移动的影响规律、根据压强对化学平衡的影响规律画出图像、根据各组分(起始、变化、平衡)浓度模型法计算平均反应速率和平衡常数、碱性甲醇-空气燃料电池的正极反应式等。
本题难度:困难
5、选择题 在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
A.x的转化率变小
B.(a+b)>(c+d)
C.z的体积分数变大
D.平衡向正反应方向移动