|
|
|
高考化学知识点整理《盐类水解的原理》高频考点预测(2019年最新版)(二)
2019-05-30 04:54:27
【 大 中 小】
|
1、选择题 物质的量浓度相同的下列溶液中,NH4+ 浓度最大的是( )
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.NH3·H2O
|
参考答案:B
本题解析:略
本题难度:一般
2、简答题 (20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH 3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。 )。
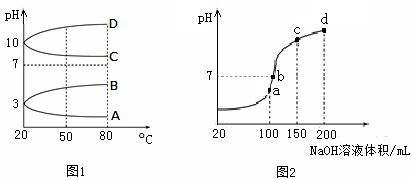
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO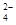 )-c(NH )-c(NH )-3c(Al3+)= mol·L-1。 )-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
参考答案:(20分)
Ⅰ、(1)2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O (2分) 0.3 (2分)
(2)Zn + 2OH- - 2e- = Zn(OH)2 (2分) 减小(2分)
Ⅱ、(1) 小于 (2分) (2)①A (2分) ②10-3-10-11 (2分)
(3)a (2分) c(Na+)>c(SO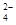 )>c(NH )>c(NH )>c(OH-)=c(H+) (2分) )>c(OH-)=c(H+) (2分)
(4)能 (2分)
本题解析:Ⅰ、(1)KClO在KOH存在条件下,把Fe(OH)3氧化为K2FeO4,同时生成KCl、H2O,根据化合价升降法配平可得化学方程式:2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O;根据Fe元素化合价变化可得:K2FeO4 ~ 3e?,所以生成0.1molK2FeO4转移的电子的物质的量为0.3mol。
(2)放电时电池的负极发生氧化反应,元素化合价升高,根据总方程式可得放电时电池的负极反应式为:Zn + 2OH- - 2e- = Zn(OH)2,根据化学方程式,充电时消耗KOH,所以充电时电解液的pH减小。
Ⅱ、(1) NH4HSO4为强酸的酸式盐,电离出的H+抑制NH4+的水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )小于 0.1 mol·L-1NH4HSO4中c(NH )小于 0.1 mol·L-1NH4HSO4中c(NH )。 )。
(2)①NH4Al(SO4)2中NH4+和Al3+水解使溶液显酸性,温度升高,水解程度增大,pH减小,故符合0随温度变化的曲线为A。
②根据示意图可知:20℃时,0.1 mol·L-1NH4Al(SO4)2pH为3,则c(H+)=10-3mol?L?1,c(OH?)= 10-11mol?L?1,根据电荷守恒可得:c(H+)+c(NH4+)+3c(Al3+)=c(OH?)+2c(SO42?),所以2c(SO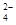 )-c(NH )-c(NH )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11 )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
(3)a点显酸性,NH4+、Al3+水解,促进了H2O的电离,b点为中性,没有其它离子干扰,c、d显碱性,NaOH过量,抑制了H2O的电离,所以水的电离程度最大的是a;b点为中性,c(H+)=c(OH?),根据电荷守恒,c(Na+)+c(NH4+)=2c(SO42?),溶液显中性,NaOH应稍过量,抵消NH4+水解产生的H+,所以离子浓度由大到小顺序为:c(Na+)>c(SO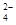 )>c(NH )>c(NH )>c(OH-)=c(H+) )>c(OH-)=c(H+)
(4)溶液的pH=5,则c(OH?)=10-9mol?L?1,带入c(Al3+)?c3(OH?)= 2.0×10-33,解得c(Al3+)= 2.0×10-6mol?L?1,所以Al3+完全沉淀。
考点:本题考查氧化还原反应、电化学原理、盐类的水解、离子浓度比较、Ksp的应用。
本题难度:困难
3、选择题 现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,②③④中水的电离程度一样大
B.将②③混合,若pH=7,则消耗溶液的体积:②<③
C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性
D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH)
|
参考答案:D
本题解析:A、酸碱抑制水的电离,CH+或COH-越大,水的电离程度越小。水的电离程度:③最小,②④相近,①最大。错误;B、将②③混合,若pH=7,则消耗溶液的体积:②>③。因为氨水是弱电解质,浓度大,则消耗溶液的体积小。错误;C、未给定体积,若CH3COOH过量,则混合液呈酸性;若恰好反应或碱过量,则混合液一定呈碱性。错误;D、将①、④等体积混合,得CH3COONa,由质子守恒得c(OH¯)=c(H+) + c(CH3COOH),正确。
考点:考查溶液里的离子浓度比较等相关知识。
本题难度:困难
4、选择题 在1.0 mol·L-1的NH4Cl溶液中,有关离子浓度的关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
参考答案:A
本题解析:
本题难度:一般
5、选择题 在0.1 mol·L-1的NaHS溶液中,下列关系式正确的是
A.c(Na+)=c(HS-)+2c(S2-)+c(H2S)
B.c(HS-)=c(Na+)+c(H+)-c(OH-)-c(S2-)
C.c(OH-)=c(H+)+c(H2S)+c(S2-)
D.c(H+)=c(OH-)+c(S2-)-c(H2S)
参考答案:D
本题解析:试题分析:本题考查学生对电解质溶液部分电荷守恒和物料守恒的理解和掌握。A选项,S2-前面有系数2,不是物料守恒表达式,有H2S分子,又不是电荷守恒关系式,A项错误。B选项,S2-带2个单位负电荷,前面应该乘以2,电荷守恒关系式错误。C选项,质子守恒关系式应为:c(OH-)=c(H+)+2c(H2S)+c(HS-),所以错误。D选项是电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)与物料守恒c(Na+)=c(HS-)+c(S2-)+c(H2S)相减的结果,正确。
考点:离子浓度大小的比较。
本题难度:困难