1、选择题 下列说法,你认为无科学性错误的是( )
A.CO2可以灭火,所以镁条着火时可用CO2灭火
B.海水的溴以Br-形式存在,所以需加入氧化剂才能提取Br2
C.氮气的化学性质稳定,所以常温下不可能发生氮的固定
D.碘遇淀粉变蓝,所以可用米汤检验含碘盐中的碘酸钾(KIO3)
参考答案:B
本题解析:
本题难度:一般
2、填空题 (13分)铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。
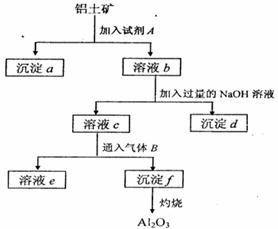
回答下列问题:
(1)沉淀物的化学式分别是:
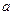 ?
? ?;d?;
?;d?;
f?;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式??、?
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式?、?。
(4)气体B能否改用试剂A代替?为什么??,? ?。
?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 甲、乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉质量为( )
A.2.7g
B.3.6g
C.5.4g
D.1.8g
参考答案:盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
63=0.3molx,解得x=0.15mol,
一定条件下,气体的物质的量之比等于体积之比,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×2=0.3mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.3mol
23=y0.3mol,解得y=0.2mol,
则铝的质量为0.2mol×27g/mol=5.4g,
故选C.
本题解析:
本题难度:一般
4、选择题 下列关于金属铝及其化合物的叙述正确的是( )
A.铝在常温下不能与氧气反应
B.铝在化学反应中容易失去电子,是氧化剂
C.铝与盐酸或强碱溶液反应都能放出氢气
D.氧化铝只能与酸反应,不能与碱反应
参考答案:A、铝的化学性质活泼,在常温下可以和氧气反应生成氧化铝,形成致密氧化膜,故A错误;
B、金属铝在反应中容易失电子,做还原剂,故B错误;
C、金属铝既可以和强酸反应又能和强碱反应生成对应的盐和氢气,故C正确;
D、氧化铝属于两性氧化物,可以和强酸反应,还能和强碱反应,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是(?)
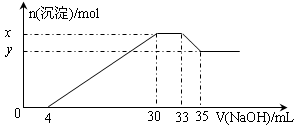
A.原溶液中n(Mg2+)∶n(Al3+)=10∶1
B.原溶液的c(H+)=0.8 mol/L
C.x与y的差值为0.01 mol
D.原溶液中c(Cl-)=0.66mol/L
参考答案:D
本题解析:由图象可知,开始加入氢氧化钠没有沉淀生成,0~4mL发生反应H++OH-=H2O,4mL时H +反应完毕,4~30mL发生反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,30mL时沉淀量最大,Mg2+、Al3+沉淀完全,30~33mL沉淀量不变,发生NH4+与氢氧化钠的反应NH4++OH-=NH3·H2O,33~35mL发生Al(OH)3与氢氧化钠的反应Al(OH)3+OH-=AlO2-+2H2O,0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×4mol?L-1=0.016mol,c(H+)=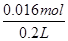 =0.08mol/L,故B错误;由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4mol?L-1=0.008mol,即Al(OH)3的物质的量=0.008mol,故C错误;溶液中的阴离子只有Cl―,则加入33mLNaOH溶液时Cl―全部存在于NaCl中,则Cl―的物质的量为33mL×10-3L×4mol?L-1=0.132mol,原溶液中c(Cl―)=
=0.08mol/L,故B错误;由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4mol?L-1=0.008mol,即Al(OH)3的物质的量=0.008mol,故C错误;溶液中的阴离子只有Cl―,则加入33mLNaOH溶液时Cl―全部存在于NaCl中,则Cl―的物质的量为33mL×10-3L×4mol?L-1=0.132mol,原溶液中c(Cl―)=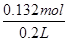 =0.66mol/L,故D正确;由C计算可知n[Al(OH)3]=0.008molmol,则原溶液中n(Al3+)=n[Al(OH)3]=0.008mol,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,则沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,则n(NaOH)=(30-4)mL×10-3L×4mol?L-1=0.104mol,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),则n[Mg(OH)2]=
=0.66mol/L,故D正确;由C计算可知n[Al(OH)3]=0.008molmol,则原溶液中n(Al3+)=n[Al(OH)3]=0.008mol,由图可知溶解Al(OH)3消耗氢氧化钠溶液5mL,则沉淀Mg2+、Al3+消耗氢氧化钠溶液26mL,则n(NaOH)=(30-4)mL×10-3L×4mol?L-1=0.104mol,根据氢氧根守恒该阶段有3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH),则n[Mg(OH)2]=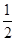 (0. 104mol-0.008mol×3)=0.04mol,故原溶液中n(Mg2+)=0.04mol,故原溶液中n(Mg2+):n(Al3+)=5:1,故A错误;
(0. 104mol-0.008mol×3)=0.04mol,故原溶液中n(Mg2+)=0.04mol,故原溶液中n(Mg2+):n(Al3+)=5:1,故A错误;
本题难度:一般