1、选择题 下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是(?)

A.NH4Al(SO4)2
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
2、填空题 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
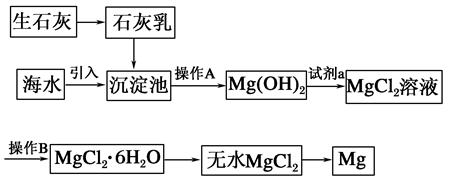
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。
3、判断题 (8分)有一包粉末状的混合物,可能含有MgCl2、FeCl3、NaOH、CuSO4、Al2(SO4)3、KNO3、CaCO3、NaCl中的两种或多种。将混合物置于水中搅拌,得无色透明溶液;再将所得无色透明溶液分为两份:一份中通入CO2,有白色沉淀出现,滴入稀盐酸沉淀消失;另一份中加入BaCl2溶液,同样有白色沉淀出现,此沉淀不溶于稀硝酸。完成下列问题:
(1)原混合物中肯定含有的物质是____________(写化学式)
(2)混合物置于水中,所得无色透明溶液中一定含有的物质是______________(写化学式)。
(3)常温下所得无色透明溶液的pH7(填“>”或“<”)。
(4)在所得无色透明溶液中有关离子方程式为___________________________________。
4、选择题 硫酸镁和硫酸铝的混合溶液中,Al3+的浓度为0.2 mol·L-1,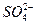 的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(?)
的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(?)
A.0.4 mol·L-1
B.0.3 mol·L-1
C.0.2 mol·L-1
D.0.1 mol·L-1
5、填空题 (1)用Al2(SO4)3制取Al(OH)3,常用氨水与Al2(SO4)3反应,而不用NaOH(aq),是什么原因? ________________________________________________________________。
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。