1、选择题 镁和铝比较,下列说法不正确的是
[? ]
A.镁和铝都是银白色的轻金属
B.因为在反应中,铝原子失去三个电子,镁原子失去两个电子,所以铝的化学性质比镁的活泼
C.铝的硬度比镁的大,熔沸点比镁的高
D.常温下,镁和铝的表面都能生成一层致密而坚固的氧化膜,从而失去金属光泽并且有耐腐蚀性
参考答案:B
本题解析:
本题难度:简单
2、填空题 A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是? _______?(填元素符号),其基态原子的电子排布式为? _______?。第二周期非金属元素形成的氢化物中化学键极性最大的是? _______?
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度? _______?(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是? _______?(填物质字母代号)。
(3)晶格能的大小:MgO? _______?NaCl,键能的大小:HBr? _______?HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是? _______?
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Mg(OH)2
|
pH值
| 5.2
| 3.2
| 9.7
| 10.4
| 11.2
|
表2?两种盐的溶解度(单位为g/100g水)
温度 / ℃
| 10
| 30
| 40
| 50
| 60
|
CaSO4
| 0.19
| 0.21
| 0.21
| 0.20
| 0.19
|
MgSO4·7H2O
| 30.9
| 35.5
| 40.8
| 45.6
| /
|
硼镁泥制取七水硫酸镁的工艺流程如下:
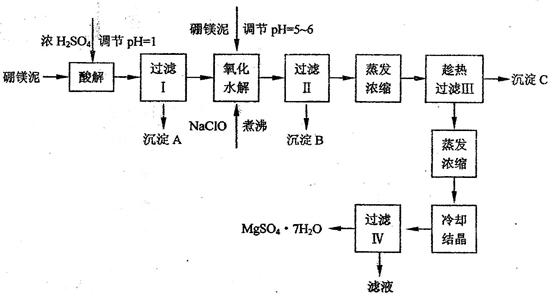
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为? _______?。加热煮沸的主要目的是_? _______?。
(2)沉淀B中除MnO2、SiO2外还含有? _______?(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是? _______?;
(4)沉淀C的化学式是? _______?。过滤II需趁热过滤的理由是? _______?
参考答案:A、(1)Na? 1S22S22P63S1? HF?小?
(2)B?
(3)>? >?
(4)B?
B、
(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-; 促进Al3+、Fe3+水解及Mn2+氧化成MnO2
(2)Fe(OH)3、 Al(OH)3
(3)取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)CaSO4·2H2O或CaSO4; 以防MgSO4在温度低时结晶析出。
本题解析:A (2)B的熔沸点明显高于A,且水中溶解度也大于A。(3)MgO的离子所带电量都大于NaCl,而离子半径又小于NaCl,所以离子键强度大于NaCl,晶格能大。HBr键长比HI短,键能大。
本题难度:一般
3、实验题 某研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题。
【探究一】实验方案: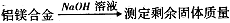 。
。
问题讨论:(1)实验中发生反应的化学方程式是?。
(2)若实验中称取5.4g铝镁合金粉末样品,投入VmL2.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥?mL。?
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为?。
【探究二】实验方案:称量xg铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:(4)欲计算Mg的质量分数,该实验中还需测定的数据是?。

(5)假设实验中测出该数据为yg,则原铝镁合金粉末中镁的质量分数为?(用含x、y代数式表示)。
[探究三]实验方案: 。
。
问题讨论:(6)同学们拟选用下边的实验装置完成实验,你认为最简易的装置其连接顺序是:
a接?。(填接口字母,仪器不一定全选。)?

(7)同学们仔细分析(6)中连接的实验装置后,又设计了下左图所示的实验装置。

①装置中导管a的作用是?。
②实验前后碱式滴定管中液面读数分别如上右图,则产生氢气的体积为?mL。
③与上左图装置相比,用(6)中连接的装置进行实验时,容易引起误差的原因是?(任写一点)。
参考答案:
(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)97
(3)过滤、洗涤、干燥固体
(4) 灼烧后固体的质量
(5) 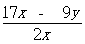
(6) edg
(7)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下。
②16.00mL
③稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。
本题解析:
(1)镁不与NaOH溶液反应,铝可以与NaOH溶液反应,所以2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)“含镁3%一5%的铝镁合金(不含其它元素)”,含Mg的最小质量为5.4X3%="0.162g," 则含铝的质量:? 5.4-0.162=5.238g,n(Al)=5.238÷27=0.194mol,根据方程式可知,需要NaOH至少97mL.
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为过滤、洗涤、干燥固体.
(4)Mg和铝分别生成MgO和Al2O3,所以要称量灼烧后固体的质量。
(5)设Mg为nmol,Al为m mol,列二元一次方程求解,24n+27m=x和40n+51m=y,求得
m(Mg)= ,则镁的质量分数为。
,则镁的质量分数为。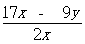
(6)只要能测量出水的体积,就可知道生成氢气的体积,所以最简单的装置连接就是让气体把水压入量筒中,进入量筒内水的体积就是氢气的体积。选edg即可。
(7)①导管a是利用连通器原理,目的是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下。
②利用前后的体积差18.50-2.50=16.00mL
③稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。
本题难度:一般
4、选择题 下列图像正确的是
A.
B.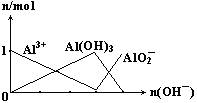

C.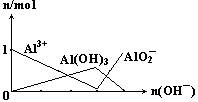
D.

参考答案:B
本题解析:根据化学方程式,1mol铝离子与 3mol氢氧根生成1mol氢氧化铝沉淀,1mol氢氧化铝沉淀与1mol氢氧根生成1mol偏铝酸根。
本题难度:简单
5、推断题 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。?
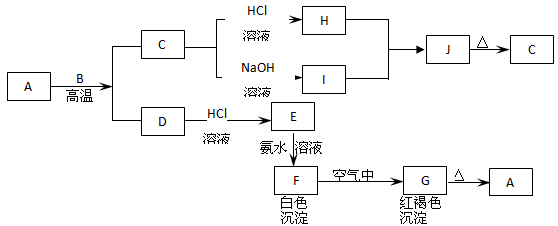
(1)A的化学式是 ______________
(2)F在空气中转化为G的化学方程式:_______________
(3)C转化为I的离子方程式:____________________
(4)H和I生成J的离子方程式:___________________
(5)D在高温下和水蒸气反应的化学方程式:____________________
参考答案:(1)Fe2O3
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al2O3+2OH-+3H2O=2[Al(OH)4]- (或Al2O3+4OH-=2AlO2-+2H2O)
(4)Al3++3[Al(OH)4]-=4Al(OH)3 ↓ (或Al3++3AlO2-+6H2O=4Al(OH)3↓)
(5)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
本题解析:
本题难度:一般