|
|
|
高考化学必考知识点《离子共存》考点巩固(2019年最新版)(八)
2019-05-30 05:17:21
【 大 中 小】
|
1、选择题 某同学对一无色透明溶液进行分析,得出该溶液中含有下列某组离子,你认为该组离子应是 (? )
A.Ca2+、H+、HCO3ˉ、Na+
B.Al3+、NO3ˉ、K+、SO42ˉ
C.OHˉ、CO32-、Ca2+、SO42ˉ
D.Fe3+、Mg2+、NO3ˉ、Clˉ
参考答案:B
本题解析:略
本题难度:一般
2、选择题 碱性溶液中能大量共存且溶液为无色透明的离子组是 (?)
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Fe3+、Na+、Cl-、SO42-
参考答案:B
本题解析:A、MnO4-是紫色的与溶液为无色透明向违背。错误。B.选项中的离子与OH-不会发生任何反应,可以大量共存。正确。C. OH-+ H+=H2O.不能大量共存。错误。D. Fe3++3OH-=Fe(OH)3↓.发生反应离子不能大量共存。错误。
本题难度:一般
3、选择题 某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+
|
参考答案:B
本题解析:某溶液既能溶解Al(OH)3,又能溶解H2SiO3,所以该溶液一定显碱性。则HCO3-、H+、Mg2+、Ag+等均不能大量共存,答案选B。
考点:考查离子共存的正误判断
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:困难
4、选择题 下列对溶液叙述正确的是
A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小
B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的PH相等,则m<n
C.常温下,5ml0.02mol/LHCl溶液与5ml0.02mol/LBa(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液的PH=12
D.常温下将稀NaOH溶液与醋酸溶液混合,可能出现PH>7的情况,且c(OH-)>c(Na+)>c(CH3COO-)>c(H+)
参考答案:C
本题解析:A项:冰醋酸是弱电解质,加水稀释过程中,H+的浓度是先变大,后变小,故错;B项:氨水中的一水合氨是弱电解质,稀释过程中碱性变化没有强碱氢氧化钠快,故m>n,故错;D项:c(Na+)总要大于c(OH-),故错。故选C。
点评:本题主要考查的是有关水溶液中电解质的知识,题目难度中等,注重基础知识的掌握及应用。
本题难度:一般
5、实验题 某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有?、?(填仪器名称),操作Ⅱ必须用到的仪器是?(填编号)。
A.50mL烧杯
B.50mL量筒
C.100mL量筒
D.25mL酸式滴定管
|
(2)①的X可选用(填化学式),其目的是
?。加入氨水要过量的原因是
?。
(3)检验沉淀是否已经洗涤干净的操作是
?。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是
?(列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果
?(“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示

。
对图中a点的说法正确的是
?(填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
参考答案:(14分)(1)250ml容量瓶(1分) 胶头滴管(1分); D(1分)
(2)H2O2或Cl2或HNO3等(1分);使Fe2+被氧化为Fe3+(1分);使Fe3+成分沉淀(1分)
(3)取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净(其他合理答案均可)(2分)
(4)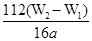 ×100%(2分);偏大(2分)?(5)②(2分)
×100%(2分);偏大(2分)?(5)②(2分)
本题解析:(1)操作Ⅰ是配制一定物质的量浓度溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有250ml容量瓶和胶头滴管。操作Ⅱ是量取25.00ml溶液,需要滴定管。溶液显书写需要酸式滴定管,答案选D。
(2)由于溶液中含有亚铁离子,需要将其氧化生成铁离子,所以X应该是氧化剂,可以选择H2O2或Cl2或HNO3等。由于要使溶液中的铁离子完全沉淀生成氢氧化铁,所以加入的氨水应该是过量的。
(3)由于沉淀表面含有Cl-,所以可以通过检验Cl-来检验沉淀是否洗涤干净,即取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净。
(4)氢氧化铁分解生成氧化铁,则氧化铁的质量是(W2-W1)g,所以干净原子守恒可知,样品中铁元素的含量是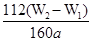 ×10×100%=
×10×100%=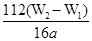 ×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。
×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。
(5)①、氯化铵固体溶于水,NH4+水解,溶液的酸性增强,pH降低,所以不可能使溶液由a点沿水平方向变到Cu2+曲线上,①不正确;②、温度不变,则溶液中水的离子积常数是不变的,②正确;③、a点均不在曲线上,其中铁离子已经完全沉淀,铜离子没有沉淀,是不饱和溶液,③不正确,答案选②。
本题难度:困难
 。
。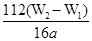 ×100%(2分);偏大(2分)?(5)②(2分)
×100%(2分);偏大(2分)?(5)②(2分)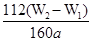 ×10×100%=
×10×100%=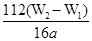 ×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。
×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。