| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应速率》试题预测(2019年最新版)(六)
参考答案:(1)0.001 本题解析:(1) 本题难度:一般 2、选择题 改变下列条件,可以提高反应物中的活化分子百分数的是( ) 参考答案:加入催化剂可提高反应物中的活化分子百分数;降低温度降低反应物中的活化分子百分数,而压强和浓度只改变活化分子的浓度,不改变百分数, 本题解析: 本题难度:简单 3、选择题 在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是 |
参考答案:B
本题解析:①升高温度;②加入正催化剂;③增大反应物浓度;④将固体块状反应物磨成粉末;均能是反应速率加快,⑤增大压强仅针对平衡体系中存在气体的反应,对于非气体反应的体系中增大压强反应速率不变,故⑤不一定能是反应速率增大,故B项正确。
考点:影响化学反应速率公式。
本题难度:一般
4、填空题 氯酸钾和亚硫酸氢钠发生氧化还原反应生成-1价Cl和+6价S,反 应速率如下图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强。试回答: 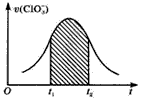
(1)下列说法中不正确的是 (? )
A.反应开始时速率增大可能是c(H+)增大所致
B.纵坐标为v(H+)的v-t曲线与图中曲线完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”可以表示t1~t2时间内c(Cl-)增加
(2)写出该反应的离子方程式____。
(3)反应开始时反应速率加快的原因是___。
(4)反应后期反应速率下降的原因是____。
参考答案:(1)B
(2)ClO3-+3HSO3-=Cl-+3H++3SO42-
(3)反应生成H+,溶液中c(H+)增大,ClO3-的氧化性增强
(4)反应物浓度逐渐减小
本题解析:
本题难度:一般
5、选择题 一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的
[? ]
A.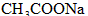 (固体)
(固体)
B.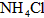 (固体)
(固体)
C.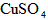 (溶液)
(溶液)
D.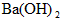 (固体)
(固体)
参考答案:A
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《分子式、结构式、.. | |