1、选择题 最近医学界通过用放射性15C跟踪标记C60, 发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是
A.与C60中普通碳原子的化学性质不同
B.与16O的中子数相同
C.是金刚石的同素异形体
D.与12C互为同位素
参考答案:D
本题解析:互为同位素的原子化学性质是相同的,A不正确;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以选项B中中子数是不同的,不正确;由同一种元素形成的不同单质互为同素异形体,15C是核素,表示单质,则选项C不正确。质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以选项D正确,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练。该题的关键是明确原子组成的表示方法和有关微粒之间的数量关系,以及同位素和同素异形体的概念和判断依据,然后灵活运用即可。
本题难度:简单
2、选择题 下列分散系属于胶体的是
A.FeCl3溶液
B.CuSO4溶液
C.碘酒
D.有色玻璃
参考答案:D
本题解析:
本题难度:一般
3、选择题 砷为第四周期第ⅤA族元素,则砷不可能具有的性质:?
A.砷通常情况下是固体
B.砷可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱
D.砷的非金属性比磷强
参考答案:D
本题解析:略
本题难度:简单
4、填空题 图示法和图像法都是常用的科学研究方法。
(1)科学家通过X射线推测胆矾中既含有配位键又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
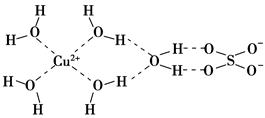
①写出基态Cu原子的核外电子排布式________________________________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________。
(2)下图是研究部分元素氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________(填“a”或“b”),理由是______________________________________________________________。

(3)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。如图所示:
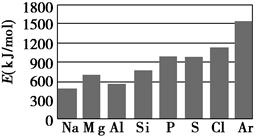
①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,试推断E氧________E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁________E钙。
参考答案:(1)①1s22s22p63s23p63d104s1或[Ar]3d104s1
②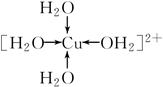
(2)ⅣA b A点表示的氢化物是水,其沸点高是由于在水分子之间存在氢键,氢键的强度远大于范德华力。所以氧族元素中其他氢化物的沸点不会高于水
(3)①增大 ②< ③>
本题解析:胆矾晶体中存在配离子[Cu(H2O)4]2+,H2O中的O原子提供孤电子对,Cu2+提供空轨道形成配位键,从而可以写出水合铜离子的结构简式。(2)由图示氢化物的沸点变化规律看出,c的氢化物沸点逐渐升高,说明没有氢键的影响,应是第ⅣA族元素。折线a和b都说明氢化物中含有氢键,第二周期氢化物的沸点为100 ℃,应为第ⅥA族元素,但a线的变化趋势不对,b正确。(3)同周期内,随着原子序数的增大,第一电离能总趋势是逐渐增大;同主族内,随着电子层数的增多,第一电离能总趋势是逐渐减小。
本题难度:一般
5、简答题 (13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
?元素编号
| 元素特征信息
|
A
| 其单质是密度最小的物质
|
B
| 其阴离子带两个单位的负电荷,单质是空气主要成分之一
|
C
| 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4
|
D
| 其氢氧化物和氧化物都有两性,且与C同周期
|
E
| 与C同周期,其原子半径在该周期最小
|
R
| 有多种化合价,其最高正价为+6价
|
回答下列问题:
(1)写出下列元素的名称:C?,E?;画出B的阴离子结构示意图:??。
(2)B、C、D的简单离子半径由大到小的顺序是?(用化学式表示)。E元素的最高价含氧酸的化学式是?;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是:?。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是?(填序号)。
A.元素R位于周期表中第3 周期,ⅥA族?
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。?;?。
参考答案:
(1)镁?氯?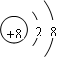 ?(2)? O2->Mg2+>Al3+ ?;HClO4
?(2)? O2->Mg2+>Al3+ ?;HClO4
(3)向其氢氧化物(或氧化物)中分别加入足量NaOH溶液、盐酸,固体都能够溶解。 (4)AD ;
(5)Mg+2H+=Mg2++H2↑(或2Al+6H+=2 Al3++3H2↑;或3Mg+2Al3+=3Mg2++2Al)
Cl2+S2-=S↓+2Cl-(或Cl2+H2S=S↓+2Cl-+2H+)
本题解析:根据题意可推知这几种元素分别是:A是H;B是O;C是Mg;D是Al; E是Cl;R是S。(1)C元素的名称是镁;E元素的名称为氯;(2)O、Mg、Al的离子的电子层结构相同,都是2、8的排布。对于电子层结构相同的微粒来说,离子的核电荷数越大,离子的半径就越小。所以简单离子半径由大到小的顺序是O2->Mg2+>Al3+;Cl元素的原子最外层有7个电子,最高化合价为+7价,所以其最高价含氧酸的化学式是HClO4。(3)证明Al(OH)3具有两性的操作方法是向Al(OH)3中分别加入足量NaOH溶液、盐酸,固体都能够溶解。就可证明。(4)A. S的核外电子排布是2、8、6,因此元素R位于周期表中第3 周期,ⅥA族。正确。B.S2-与Ar原子电子层结构相同。错误。C.SO32-在有的反应中具有氧化性,在有的反应中表现还原性。错误。D.根据氧化还原反应中的电子转移数目相等可知在反应RO32-+2R2-+6H+ = 3R+3H2O中,每消耗1 mol RO32- ,转移的电子的物质的量为4 mol。正确。(5)符合题意的两个反应的离子方程式是Mg+2H+=Mg2++H2↑;Cl2+S2-=S↓+2Cl-等。
本题难度:一般