1、选择题 下列各离子化合物中,阳离子与阴离子的半径之比最小的是( ? )
A.KCl
B.NaBr
C.LiI
D.KF
参考答案:C
本题解析:四选项中阳离子半径最小的为:Li+,阴离子半径中最大的为:I—;故C项符合题意
本题难度:简单
2、填空题 (14分)X、Y、Z三种化合物均由短周期元素组成。已知三种化合物的水溶液的焰色反应均呈黄色,Y和Z均由三种元素组成。请根据题目的要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键为?(填序号)。
A.离子键? B.极性共价键? C.非极性共价键
(2)写出X与二氧化碳反应的化学方程式?。
(3)下表为Y和Z实验的部分内容
序号
| 主要实验步骤及实验现象
|
①
| 在Y的无色溶液中,加入稀硫酸,放置。产生浅黄色沉淀和无色有刺激性气味的气体。该气体可使品红溶液褪色。
|
②
| 在Z的无色溶液中,滴加的盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。
|
③
| 将实验②最终得到的混合物加热蒸发、灼烧,最终得到固体。
|
写出含0.1 mol Z的溶液与20 mL 5mol/L的盐酸反应的离子方程式:
?
实验③加热蒸发、灼烧得到的最终产物主要是?和?。
(4)写出Y与稀硫酸反应的离子方程式?。
参考答案:(1)AC;(2)2Na2O2 + 2CO2 = 2Na2CO3 + O2↑;
(3)AlO2—+ H+ + H2O = Al(OH)3↓;NaCl和Al2O3;
(4)S2O32—+2H+=S↓+SO2↑+H2O
本题解析:根据焰色反应可知均为钠盐,固体化合物X为过氧化钠,Y 为Na2S2O3,Z为NaAlO2?。2Na2O2 + 2CO2 = 2Na2CO3 + O2↑;AlO2—+ H+ + H2O = Al(OH)3↓;S2O32—+2H+=S↓+SO2↑+H2O。
本题难度:一般
3、选择题 下列说法正确的是(?)
A.基态时相同周期的两种元素的原子所占用的能级和能层是一样的
B.基态时稀有气体元素原子的价层电子数都为8
C.基态时同种元素的原子和离子的轨道排布式一样
D.非金属元素原子的d轨道一定不填充电子或填满电子
参考答案:D
本题解析:同周期自左向右核电荷数逐渐增多,基态时相同周期的两种元素的原子所占用的能级和能层是不一样的,A不正确。B不正确,He是2.C不正确,例如钠原子和钠离子不同。非金属元素的最外层电子数一般大于3个,即非金属元素除了氢元素位于s区外,其余都位于sp区,所以正确的答案选D。
本题难度:简单
4、填空题 元素A和B分别是处于第三、四周期的主族元素,它们的离子的电子层相差两层。已知A处于第m主族,B处于第n主族,且B的单质中含有共价键 。
(1)A原子核外的电子总数是___________,最高价氧化物的化学式是___________。
(2)B原子的结构示意图是___________,其气态氢化物的化学式是___________。
(3)若它们的离子均带一个单位的电荷,则A是___________元素,B单质的电子式为___________。
参考答案:(1)m+10? A2Om或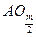 ,
,
(2)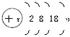 ,其中x="28+n?" H(8-n)R或RH(8-n)
,其中x="28+n?" H(8-n)R或RH(8-n)
(3)钠?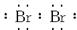
本题解析:(1)A原子位于第三周期,即有三个电子层,第一、二层排满共有10个电子,第三层为最外层,所排的电子数等于族序数,即m个电子,故A原子核外电子总数为(10+m)个,最高价也与族序数相等,即+m价,故最高价氧化物的化学式为A2Om或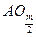 ;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为:
;(2)同理分析可得B原子有四个电子层,每层所排电子数依次为2、8、18、n(这里容易出错的是第三层排8个电子,因B有气态氢化物,说明B是非金属元素,其位置在过渡区之后,故正确的是排18个电子),B原子的最高价为+n,则在气态氢化物中显示-(8-n)价,故结构示意图和气态氢化物的化学式依次为: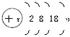 ,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶
,其中x=28+n,H(8-n)R或RH(8-n);(3)根据题意,A是钠元素,B是溴元素,则B单质的电子式为∶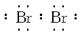 。
。
本题难度:一般
5、选择题 已知X、Y为短周期元素,两元素形成化合物XY3,已知其原子序数分别为a和b,则a不可能为(?)
A.b+4
B.b-5
C.b+6
D.b+8
参考答案:B
本题解析:由化合价分析X、Y两元素应分别处于IIIA族和VIIA族,但本题更要注意特例,比如NH3、SO3等。
本题难度:一般