1、选择题 钠与水反应时的现象与钠的下列性质无关的是
A.钠的熔点低
B.钠的硬度小
C.钠的密度小
D.钠的金属活动性强
参考答案:B
本题解析:分析:钠与水反应时产生的各种现象如下:钠浮在水面然后熔化成闪亮黄色小球在水面游动并发出嘶嘶的响声溶液由无色变为红色.原因如下:
浮:密度比水小,熔:熔点低,游 嘶:剧烈反应,红:生成碱性物质.
解答:A、因钠与水反应放热,钠的熔点低,所以看到钠熔成闪亮的小球,故A与性质有关;
B、硬度大小与反应现象无关,故B与性质无关;
C、钠的密度比水小,所以钠浮在水面上,故C与性质有关;
D、因钠的金属性强,所以与水反应剧烈,故D与性质有关;
故选:B.
点评:本题考查了钠与水的反应.应从钠的强还原性和钠的物理性质来理解钠与水反应的现象.
本题难度:困难
2、选择题 下列过程与配合物的形成无关的是
A.向一定量的硝酸银溶液中加入氨水至过量
B.除去铁粉中的氧化铝可用强碱溶液
C.向一定量的硫酸铜溶液中加入氨水至沉淀消失
D.向Fe3+溶液中加入KSCN溶液后溶液呈血红色
参考答案:B
本题解析:
本题难度:困难
3、选择题 下列物质转化在给定条件下不能实现的是
A.Fe2O3FeCl3(aq)无水FeCl3
B.Al2O3NaAlO2(aq)AlCl3
C.NH3NOHNO3
D.饱和NaCl(aq)NaHCO3Na2CO3
参考答案:A
本题解析:分析:A、氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得不到无水FeCl3;
B、氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液加入盐酸,生成氯化铝;
C、氨气的催化氧化会生成一氧化氮,一氧化氮易被氧化为二氧化氮,二氧化氮溶于水中得到硝酸;
D、在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠.
解答:A、氧化铁与盐酸反应生成氯化铁,Fe3+水解Fe3++3H2O?2Fe(OH)3+HCl,加热蒸发HCl挥发,平衡向右移动,得不到无水
FeCl3,故A选;
B、氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液加入盐酸,生成氯化铝,故B不选;
C、氨气的催化氧化会生成一氧化氮,一氧化氮易被氧化为二氧化氮,二氧化氮溶于水中得到硝酸,故C不选;
D、在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故D不选.
故选A.
点评:本题考查学生元素化合物、侯氏制碱法、盐类的水解等方面的知识,注意知识的梳理和归纳是解题的关键,难度不大.
本题难度:困难
4、选择题 下列物质可以由对应的单质直接化合生成的是
A.SO3
B.FeS
C.CuS
D.FeCl2
参考答案:B
本题解析:试题分析:A、S和O2直接化合生成SO2,不能生成SO3,错误;B、Fe与S直接化合生成FeS,正确;C、Cu与S直接化合生成Cu2S,不能生成CuS,错误;D、Fe与Cl2直接化合生成FeCl2,正确。
考点:考查铁、铜与硫、氯气的反应、硫与氧气的反应等相关知识。
本题难度:困难
5、选择题 由Zn、Fe、Al、Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是
A.Zn
B.Al
C.Fe
D.Mg
参考答案:B
本题解析:分析:计算出氢气的质量,根据氢气的质量计算出各自反应时所需金属的质量,两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.
解答:在标况下氢气的物质的量为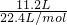 =0.5mol,
=0.5mol,
?Zn~H2
65g? 1mol?
32.5g? 0.5mol
所以生成氢气11.2升,需要Zn的质量为32.5g.
2Al~3H2
54g? 3mol?
9g?0.5mol
所以生成氢气11.2升,需要Al的质量为9g.
Fe~H2
56g? 1mol?
28g? 0.5mol
所以生成氢气11.2升,需要Fe的质量为28g.
Mg~H2
24g? 1mol?
12g? 0.5mol
所以生成氢气11.2升,需要Mg的质量为12.
两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.只有Al的质量小于10g,所以混合物中一定含有Al.
故选B.
点评:本题考查混合物的有关计算,难度中等,本题采取极值法解答,从而简化计算.注意若有不反应的金属应视作需金属质量无穷大.
本题难度:一般