|
高考化学知识点总结《金属的腐蚀与防护》考点巩固(2019年最新版)(八)
2019-05-30 05:39:21
【 大 中 小】
|
1、选择题 下列对金属及其制品的防护措施中,错误的是
A.把Cr、Ni等金属加入到普通钢里制成不锈钢铁
B.通过特殊工艺,增加铝制品表面的氧化膜
C.对于易生锈的铁制品要定期刷防护漆
D.锅用完后,用水刷去其表面的油污,置于潮湿处
参考答案:D
本题解析:油对铁有保护作用,不用清洗,铁在潮湿的地方更容易生锈,D正确。
本题难度:简单
2、选择题 如图,液面上浮着一个空心铁球,数天后可观察的现象是( )
①铁球表面出现红色锈斑?②铁球表面出现黑色锈斑
③量筒内水位下降?④量筒内水位上升.
A.①③
B.①④
C.②③
D.②④
| 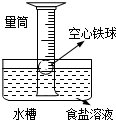
参考答案:铁和碳、氯化钠溶液构成原电池,较活泼的金属铁作负极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应生成氢氧根离子导致量筒内气体压强降低,外界大气压不变,所以水会进入量筒,导致量筒内液面上升,氢氧根离子和二价铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被空气中的氧气氧化成氢氧化铁,所以铁球表面会出现红色锈斑,故选B.
本题解析:
本题难度:一般
3、选择题 用惰性电极电解下列溶液,在阴、阳两极生成气体的体积比为1∶1的是(? )
A.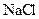 溶液 溶液
B.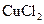 溶液 溶液
C.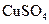 溶液 溶液
D. 溶液 溶液
参考答案:A
本题解析:用惰性电极电解电解质溶液,有四种类型:①电解水型:含氧酸酸、可溶性碱、活泼金属的含氧酸盐;②电解电解质型:无氧酸、不活泼金属的无氧酸盐;③放氢生碱型:活泼金属的无氧酸盐;④放氧生酸型:不活泼金属的含氧酸盐。
A属于③类,电解方程式为:2NaCl+2H2O=Cl2↑(阳极)+H2 ↑(阴极)+2NaOH ,A正确。B属于②类,电解方程式为:CuCl2=Cu(阴极)+Cl2(阳极)↑ ,阴极没有气体生成,B不正确。C属于④类,电解方程式为:2CuSO4+2H2O = 2Cu(阴极)+ O2↑(阳极)+2H2SO4,阴极没有气体生成,C不正确。D属于①类,电解方程式为:2H2O=2H2↑(阴极)+O2↑(阳极),阴、阳两极生成气体的体积比为2∶1,D不正确。
本题难度:简单
4、填空题 工业上处理含有Cr2O72-的酸性工业废水,通常有两种处理方法。第一种方法是:先加入绿矾(FeSO4·7H2O),把废水中的Cr2O72-还原成Cr3+离子,再加入过量的石灰水,使Cr3+转变为Cr(OH)3沉淀。第二种方法是:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极?,阴极?。
(2)Cr2O72-转变成Cr3+的离子反应方程式:?。
(3)采用第二种方法时,往工业废水里加入适量的NaCl的目的是?。
(4)能否用石墨电极来代替Fe电极??(填“能”或“不能”),简述理由:
?。
参考答案:(1)Fe-2e-=Fe2+(1分) 2H++2e-=H2↑(1分)
(2)6Fe2++ Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O(2分)
(3)增强溶液(或废水)的导电性。(1分)
(4)不能,因为阳极不能产生能将Cr2O72-还原到Cr3+的Fe2+。(2分)
解析:由于Cr(Ⅵ)的化合物毒性远高于Cr(Ⅲ)化合物,将Cr(Ⅵ)转化为Cr(Ⅲ),对废水进行处理是电化学知识在实际生活中的具体运用。在处理有关问题时,应注意思维的有序性:首先应考虑,溶液中阴阳离子在外电场作用下的定向迁移;然后再考虑阴阳两极按放电顺序可能发生的电极方程式。阴极:2H++2e-=H2↑,阳极:Fe-2e-=Fe2+,产生的Fe2+在向阴极迁移的过程中与向阳极迁移的Cr2O72-相遇,发生氧化还原反应:6Fe2++ Cr2O72-+14H+ = 6Fe3++2Cr3++7H2O,使Cr2O72-转化为Cr3+,同时Fe2+也转化为Fe3+。在以上电解的阴极反应及Fe2+与Cr2O72-的氧化还原反应中都消耗了大量的H+,溶液的pH不断变大,有利于Fe3+,Cr3+生成相应的Fe(OH)3、Cr(OH)3沉淀。若将Fe电极改成为石墨电极,由于不能产生的Fe2+,而不能将Cr2O72-转化为毒性较低的Cr3+,显然是不行的。
本题解析:略
本题难度:一般
5、填空题 锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为?。
(2)写出“正极碱浸”中发生反应的离子方程式?。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式?;可用盐酸代替H2SO4和H2O2的混合液,但缺点是?。
(4)写出“沉钴”过程中发生反应的化学方程式?。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式?。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是?。在整个回收工艺中,可回收到的金属化合物有?(填化学式)。
参考答案:
(1)+3
(2)2Al + 2OH- + 6H2O = 2Al(OH)- 4 + 3H2↑
(3)2LiCoO2 + 3H2SO4 + H2O2 Li2SO4 + 2CoSO4 + O2↑+ 4H2O Li2SO4 + 2CoSO4 + O2↑+ 4H2O
2H2O2 2H2O + O2↑ ;有氯气生成,污染较大。 2H2O + O2↑ ;有氯气生成,污染较大。
(4)CoSO4 + 2NH4HCO3 = CoCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O
(5) Li1-xCoO2 + LixC6 = LiCoO2 + 6C
(6)Li+从负极中脱出,经由电解质向正极移动并进入正极材料中
Al(OH)3、CoCO3、Li2SO4
本题解析:以工艺流程为背景考查化学反应原理中的电化学知识,包括电极反应式的书写、氧化还原反应,综合性较强。
(1)根据化合价代数和为0的原则,LiCoO2中Li为+1价,O为-2价,iCo元素的化合价为+3。
(2)根据工艺流程和相关产物可知,锂离子电池正极材料中只有铝箔与氢氧化钠反应,发生反应的离子方程式2Al + 2OH- + 6H2O = 2Al(OH)- 4 + 3H2↑。
(3)根据“酸浸”的反应物和反应条件,发生的所有氧化还原反应的化学方程式为;2LiCoO2 + 3H2SO4 + H2O2 Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2 Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2 2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。 2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。
(4)根据“沉钴”过程中反应物和产物,发生反应的化学方程式CoSO4 + 2NH4HCO3 = CoCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,放电时负极发生的反应为LixC6-xe-=6C+xLi+,正极Li1-xCoO2 + xe- = LiCoO2 + xLi+,电池总反应方程式Li1-xCoO2 + LixC6 = LiCoO2 + 6C。
(6)进行放电处理时,Li+从负极中脱出,经由电解质向正极移动并进入正极材料中,有利于锂在正极的回收。根据整个工艺流程的化学反应原理,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4三种。
【考点定位】工艺流程、电化学、离子方程式
本题难度:一般
| 