1、选择题 对于化学反应3W(g)+2X(g)=4Y(g)+3Z(s),下列反应速率关系中,正确的是( )
A.υ(W)=υ(Z)
B.3υ(W)=2υ(X)
C.2υ(X)=υ(Y)
D.3υ(W)=4υ(Y)
参考答案:A、由于Z为固体浓度为常数,不能用来表示速率,故A错误;
B、由化学计量数可知,v(W):v(X)=3:2,故B错误;
C、由化学计量数可知,v(X):v(Y)=2:4=1:2,即2v(X)=v(Y),故C正确;
D、由化学计量数可知,v(W):v(Y)=3:4,即4v(W)=3v(Y),故D错误;
故选:C.
本题解析:
本题难度:一般
2、选择题 合成氨工业采用下列措施是为了使平衡正向移动而提高反应物转化率的是(?)
A.采用高温
B.采用高压
C.使用催化剂
D.以上均不对
参考答案:B
本题解析:合成氨是气体体积缩小的放热反应,所以使平衡正向移动、反应物转化率提高的措施可以是高压,B正确;高温平衡逆向移动、催化剂对平衡移动无影响,A、C错误。
点评:合成氨是放热反应。
本题难度:一般
3、填空题 在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
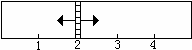
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
参考答案:(1)逆反应? 1.25<x<1.75?(2)正反应 ?25%
本题解析:(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了

平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y? =1.5,二氧化硫的体积分数="1.5/6=25%" ;
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。
本题难度:困难
4、填空题 (6分)对于溶液中进行的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl,当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加水稀释时,化学平衡向_______移动
参考答案:(1)不变?(2)变深?(3)逆反应
本题解析:该反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,所以向溶液中加入少量的KCl固体时,平衡不移动,溶液颜色不变;向溶液中加入少量KSCN固体,平衡向正反应方向移动,颜色变深;稀释,则物质的浓度降低,颜色变浅.,平衡向逆反应方向移动。
本题难度:一般
5、填空题 (8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
参考答案:(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+
(4)中 mol·L-1
本题解析:本题考查化学平衡的移动、热化学方程式、溶解平衡、溶液中离子浓度大小比较等知识,意在考查考生运用化学基本理论知识的能力。(1)在恒温、恒压条件下向平衡体系中通入氩气,容器体积增大,反应气体的浓度减小,平衡将向气体物质的量增大的方向移动,即向左移动。
(2)根据盖斯定律,ΔH=ΔH1+ΔH2-ΔH3=-77.6 kJ·mol-1。
(3)Ksp[Mg(OH)2]>Ksp[Cu(OH)2],MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀。
(4)因为氨水与盐酸反应后,生成氯化铵溶液,依据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),所以溶液呈中性;NH3·H2O的电离常数Kb== mol/L。
本题难度:一般