1、选择题 CaF2的Ksp=5.3×10-9,在c(F-)=3. 0mol·L-1的溶液中,Ca2+的最大浓度是
[? ]
A.1.8×10 -9 mol.L-1
B.1.8×10-10 mol.L-1
C.5.9×10 -10 mol. L-1
D.5.9×10-9 mol. L-1
参考答案:C
本题解析:
本题难度:一般
2、填空题 (16分)Ⅰ.铁是一种过渡元素,金属铁是最常用的金属之一。请回答下列问题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 ,上述反应生成的磁性固体与过量浓硝酸反应后的溶液中含有的盐的化学式为 。
(2)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。利用烧渣制绿矾的过程如下:
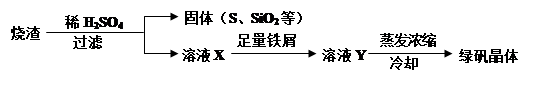
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时向FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全)
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了)。
Ⅱ.(1)某溶液中有Mg2+、Fe3+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的金属阳离子是________;用离子方程式解释其原因_________________。
(2)在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11 Ksp[Al(OH)3]="3×10" -34)。
(3)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
参考答案:Ⅰ.(1)FeC3+3O2 Fe3O4+CO2 (2分)Fe(NO3)3 (1分)
Fe3O4+CO2 (2分)Fe(NO3)3 (1分)
(2) ①2Fe3+ + H2S=== 2Fe2+ + S↓ + 2H+ (2分)
②使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体(1分)
(3)计算得c(Fe3+)=1.1×10-3mol·L-1>1×10-5mol·L-1,故Fe3+没有沉淀完全 (2分)
Ⅱ.(1)Al3+(1分),Al3++4OHˉ=AlO2ˉ+2H2O (2分)
(2) Al(OH)3 (1分) Al3++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
(3)4g(2分)
本题解析:I.(1)根据题意可知Fe3C与氧气反应生成磁性固体是四氧化三铁和使澄清石灰水变浑浊的气体是二氧化碳,化学方程式是FeC3+3O2 Fe3O4+CO2;四氧化三铁与足量的浓硝酸反应生成的盐是Fe(NO3)3;
Fe3O4+CO2;四氧化三铁与足量的浓硝酸反应生成的盐是Fe(NO3)3;
(2)①烧渣中含有氧化铁,溶于硫酸后溶液中存在铁离子,与硫化氢反应生成S单质,离子方程式为2Fe3+ + H2S=== 2Fe2+ + S↓ + 2H+;
②溶液X是铁盐溶液,加入足量的铁粉,目的是将铁离子全部转化为亚铁离子,以制备纯净的绿矾晶体;
(3)pH=3时,c(H+)=0.001mol/L,则c(OH-)=1×10-11mol/L,根据Fe(OH)3的溶度积常数Ksp=1.1×10-36,可计算此时c(Fe3+)=1.1×10-36/(1×10-11)3=1.1×10-3mol·L-1>1×10-5mol·L-1,故Fe3+没有沉淀完全;
II.(1)Mg2+、Fe3+、Al3+、Cu2+与氢氧化钠反应均生成沉淀,但生成的氢氧化铝沉淀又与氢氧化钠反应,生成偏铝酸钠,所以最终离子大量减少的是Al3+,与过量氢氧化钠溶液反应的离子方程式为Al3++4OHˉ=AlO2ˉ+2H2O;
(2)根据25℃时Ksp[Mg(OH)2]=1.8×10-11 Ksp[Al(OH)3]="3×10" -34,可知,等浓度的镁离子与铝离子相比,生成氢氧化铝所需溶液的碱性较弱,所以向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水时,先生成Al(OH)3 ;离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)设混合物中Mg、Cu的物质的量分别是x、y,根据得失电子守恒,有
2(x+y)=0.896L/22.4L/mol×3=0.12mol,则x+y=0.06mol,最后生成的沉淀是氢氧化镁、氢氧化铜沉淀,化学式中比Mg、Cu多了2(x+y)mol的OH-,所以沉淀的质量=1.96g+0.12mol×17g/mol=4g。
考点:考查金属的化学性质,氧化还原反应的计算,离子方程式的书写,沉淀完全的判断
本题难度:困难
3、填空题 (12分)按要求回答下列问题:
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是 (填字母)
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中不变
D.溶液中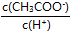 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2= (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是 (填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
溶液
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
①写出向NaClO溶液中通入少量CO2的离子方程式 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是 (填字母)
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= (填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于 。
参考答案:(12分)
(1)CD (2分) (2)①2:1(1分) ②AD (2分)
(3)①ClO-+CO2+H2O==HClO+HCO3- (2分) ②A (1分) ③1.98×10-6mol/L (2分)
(4)1/3×10-8mol/L或3.3×10-9mol/L (2分)
本题解析:(1)A、向醋酸溶液中加水稀释,则醋酸的电离平衡正向移动,所以醋酸根离子、氢离子的物质的量增大,导电粒子的数目增多,错误;B、电离平衡尽管正向移动,但最终氢离子的浓度减小,则对水的抑制作用减小,所以水电离氢离子浓度增大,错误;C、溶液中 =Ka/Kw,二者都是平衡常数,温度不变,则该常数不变,正确;D、醋酸稀释后醋酸根离子浓度减小,氢离子浓度也减小,但水的电离程度增大,所以氢离子浓度减小的程度较小,所以
=Ka/Kw,二者都是平衡常数,温度不变,则该常数不变,正确;D、醋酸稀释后醋酸根离子浓度减小,氢离子浓度也减小,但水的电离程度增大,所以氢离子浓度减小的程度较小,所以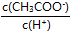 减小,正确;E、稀释时,醋酸的电离平衡正向移动,醋酸的电离度增大,但氢离子浓度减小,错误,答案选CD;
减小,正确;E、稀释时,醋酸的电离平衡正向移动,醋酸的电离度增大,但氢离子浓度减小,错误,答案选CD;
(2)①硫酸与氢氧化钠混合后的pH=1,则氢离子浓度为0.1mol/L,所以(0.1mol/L×V1mL×2-0.1mol/L×V2mL)/(V1+V2)mL=0.1mol/L,解得V1=2V2,所以V1:V2=2:1;
②A、若混合后的溶液呈中性,则c(H+)=c(OH-)=1×10-7mol/L,所以c(H+)+c(OH-)=2×10-7mol/L,正确;B、因为BOH的碱性强弱未知,所以V1=V2时,溶液可能是中性,也可能是酸性,错误;C、若V1=V2,则混合后不一定有:c(Cl-)>c(B+)>c(H+)>c(OH-),如BOH为强碱,则有若V1=V2,则混合后一定有:c(Cl-)=c(B+)>c(H+)=c(OH-),错误;D、混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-),符合电荷守恒定律,正确,答案选AD;
(3)①根据表中数据可知NaClO的碱性比碳酸钠溶液的碱性弱,则少量二氧化碳通入NaClO溶液中,只能生成碳酸氢钠和HClO,不能生成碳酸钠,则离子方程式是ClO-+CO2+H2O==HClO+HCO3-;
②将酸溶液稀释相同的倍数时,酸越弱,则加水稀释时电离度增大的程度越大,则pH增大的程度越小,四种酸中NaCN的碱性最强,说明HCN的酸性最弱,所以稀释相同倍数时pH变化最小的是HCN,答案选A;
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒,有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒,有2c(Na+)= c(CH3COO-)+c(CH3COOH),两式结合得c(CH3COO-)-c(CH3COOH)= 2c(H+)-2c(OH-)=1.98×10-6mol/L;
(4)Ksp(AgCl)=1.0×10-10= c(Cl-) c(Ag+),Ksp (CH3COOAg)=9.0×10-4= c(CH3COO-)c(Ag+),常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则CH3COOAg加入到氯化钠溶液中,形成饱和溶液时,银离子的浓度为3.0×10-2mol/L,若产生AgCl沉淀,则c(Cl-) c(Ag+)>1.0×10-10,c(Cl-)>1.0×10-10/ c(Ag+)=1/3×10-8mol/L。
考点:考查溶液中化学平衡的移动判断,溶度积常数的应用
本题难度:困难
4、选择题 将足量的AgI分别放入下列物质中,AgI的溶解度由大到小的排列顺序是(?)
①5mL0.001mol·L-1KI溶液?②15mL0.002mol·L-1CaI2溶液?
③35mL0.003mol·L-1HI溶液?④15mL蒸馏水?⑤45mL0.005mol·L-1AgNO3溶液
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:B
本题解析:根据碘化银的溶解平衡可知,只有降低银离子或碘离子的浓度,才能促进碘化银的溶解。①~⑤中碘离子或银离子的浓度分别为(mol/L)0.001、0.004、0.003、0、0.005,所以答案B是正确的。答案选B。
本题难度:一般
5、简答题 向BaCl2溶液中先后滴加AgNO3和KBr,当两种沉淀共存时,
=______.[KSP(AgBr)=5.4×10-13,KSP(AgCl)=2.0×10-10].
参考答案:当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=Ksp(AgBr)c(Ag+),c(Cl-)=Ksp(AgCl)c(Ag+),
则c(Br-)c(Cl-)=Ksp(AgBr)Ksp(AgCl)=5.4×10-132.0×10-10=2.7×10-3;
故答案为:2.7×10-3.
本题解析:
本题难度:一般