1、选择题 已知常温下:Ksp〔Mg(OH)2〕=1.8×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12 ,
Ksp(CH3COOAg)=2.3×10-3。下列叙述正确的是
[? ]
A.等体积混合浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀
C.在Mg2+为0.121 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
参考答案:AC
本题解析:
本题难度:一般
2、填空题 (8分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10? Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式:?,此反应平衡常数K的值为?。
(2)要实现该转化C(CO32-)不低于??mol/L
(3)必须更换Na2CO3溶液的原因是什么??
参考答案:(1)BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq);0.2
(2)2.5×10-4mol/L?(3)保证Na2CO3溶液的浓度不低于2.5×10-4mol/L
本题解析:(1)根据反应物和生成物可写出方程式为
BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq)。
反应的平衡常数是 。
。
(2)饱和硫酸钡溶液中,SO42-浓度是5×10-5mol/L,所以此时CO32-浓度是5×10-5mol/L÷0.2=2.5×10-4mol/L。
(3)要使沉淀转化,则必须保证Na2CO3溶液的浓度不低于2.5×10-4mol/L。
本题难度:一般
3、选择题 已知AgCl(s)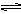 Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水?②24 mL 0.1 mol·L-1NaCl?③10 mL 0.1 mol·L-1MgCl2?④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水?②24 mL 0.1 mol·L-1NaCl?③10 mL 0.1 mol·L-1MgCl2?④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
A.③①②④
B.④①②③
C.①②③④
D.④③②①
参考答案:B
本题解析:把过量氯化银分别投入①100 mL水,存在AgCl(s)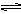 Ag+ + Cl-,
Ag+ + Cl-,
②24 mL 0.1 mol·L-1NaCl ,C(Cl-)增大,平衡左移,银离子浓度减小,②<①
③10 mL 0.1 mol·L-1MgCl2此溶液氯离子浓度比②大,平衡左移程度大,银离子浓度③<②
④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中就能电离出银离子,所以银离子浓度最大。
银离子浓度的大小顺序为:④>①>②>③,故选B。
本题难度:简单
4、简答题 以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
| 沉淀物 | 开始沉淀pH | 沉淀完全pH
Al(OH)3
3.0
5.2
Fe(OH)3
1.5
2.8
Fe(OH)2
7.6
9.7
Mg(OH)2
8.0
12.4
|
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是______.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:______.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:______.
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为______≤pH<______.
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):______.
参考答案:(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4)?3+3H2O,
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;?
(2)因FeS2将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,用化合价升价法配平方程式,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,反应的方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,故答案为:2.8≤pH<3.0;
(5)滤液未沉淀的离子为Na+、Mg2+、Al3+,Al3+和NaOH反应:Al3++3OH-=Al(OH)3↓,若NaOH过量,NaOH与Al(OH)3反应:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
本题解析:
本题难度:一般
5、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液
中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是? ( ? )
A.25℃时,0.1 mol·L-1 HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
参考答案:D
本题解析:现向lL0.2 mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则此时c(F-)×c(H+)/c(HF)=3.6×10-4,所以c(F-)=c(H+)=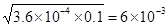 mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1.46×10-10,所以必然会析出CaF2,D正确,A和C不正确。溶度积常数和浓度没有关系,只与温度有关系,B不正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见考点和题型。试题贴近高考,综合性强,有利于培养学生的严谨的逻辑思维能力和发散思维能力,有助于培养学生的应试能力,提高学生的学习效率和学习积极性。
本题难度:简单