1、填空题 . (8分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
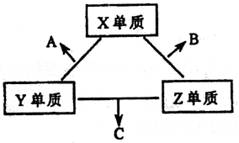
一个B分子中含有的X原子个数比A分子中多1个。请回答下列问题:
(1)分析同主族元素性质的递变规律,发现A、B物质沸点反常,这是因为它们的分子之间存在?_____________??。
(2) B在一定条件下反应生成C的化学方程式是?__??。
(3)最近科学家们合成了由Z元素形成的Z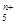 ,电子式为
,电子式为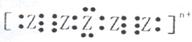 则n值____________________。
则n值____________________。
参考答案:(1)氢键(2)4NH3+5O2=催化剂,加热=4NO+6H2O(3)1
本题解析:该题中谈到X、Y、Z三种短周期元素形成的单质在常温下是无色气体,联想元素周期表,高中阶段接触最频繁的就是H、O、N三种元素符合条件。再根据表格中提到的X与Y,X与Z都能反应且所生成的B比A要多一个X原子,可让人猜测B应该是氨气,A为水,于是第一个问中关于沸点的问题便应该是氢键。至于第二问则根据课本介绍的氨的催化氧化书写出来。第三个问中的电荷数,应该采取整体观察法,Z原子在前面推测出来为N原子,括号内有5个N,最外层电子总数在不考虑其他影响因素的情况下应为25,但图表中只有24,说明其丢失了一个电子,那么就应该带上一个单位正电荷,所以n应该为1。
本题难度:简单
2、推断题 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式:_____________;F的化学名称:_______________。
(2)写出第③步反应的离子方程式为_____________________________。
(3)第④步反应中D溶液颜色的变化____________________________;写出第④步反应的离子方程式
__________________。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是_____________________________。
参考答案:(1)Cl2;氯化亚铁
(2)Fe+2H+ ==Fe2++H2↑?
(3)溶液由黄色变为浅绿色;2Fe3++Fe==3Fe2+
(4)先生成灰白色沉淀,立即变成灰绿色,最后变成红裼色
本题解析:
本题难度:一般
3、推断题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
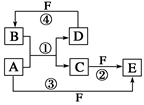
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为______________________________________________。
若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是____________________________________________,
写出反应④的化学方程式:____________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
参考答案:(1) ? C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
? C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
(2)2Fe2++Cl2== 2Fe3++2Cl-? H2+Cl2  2HCl (3)2C+SiO2
2HCl (3)2C+SiO2 Si+2CO↑
Si+2CO↑
本题解析:(1)若A为短周期金属单质,D为短周期非金属单质,则A为Mg,D为C,F为硝酸,所以A的原子结构示意图为 ,反应④的化学方程式为C+4HNO3(浓)==CO2↑+4NO2↑+2H2O ,(2)若A是常见的变价金属的单质,D、F是气态单质,则A为Fe,DF分别为氢气和氯气,反应②的离子方程式是2Fe2++Cl2== 2Fe3++2Cl-,D与F反应生成B的化学方程式为H2+Cl2
,反应④的化学方程式为C+4HNO3(浓)==CO2↑+4NO2↑+2H2O ,(2)若A是常见的变价金属的单质,D、F是气态单质,则A为Fe,DF分别为氢气和氯气,反应②的离子方程式是2Fe2++Cl2== 2Fe3++2Cl-,D与F反应生成B的化学方程式为H2+Cl2  2HCl ,(3)若A、D、F都是短周期非金属元素单质,则A、D、F分别为C、Si、O,反应①的化学方程式为
2HCl ,(3)若A、D、F都是短周期非金属元素单质,则A、D、F分别为C、Si、O,反应①的化学方程式为
2C+SiO2 Si+2CO↑。
Si+2CO↑。
点评:本题用一个图,假设不同的条件,得出不同的结果,该题信息量很大,但用到的却不多,该题比较费时,难度较大。
本题难度:一般
4、简答题 A-J是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知A是由两种元素组成的化合物,D是一种红棕色固体,H的焰色反应呈黄色.
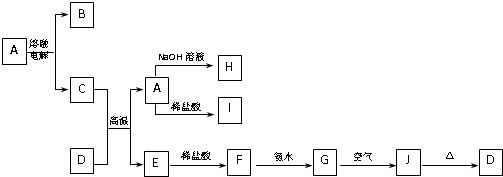
请回答下列问题:
(1)B物质的化学式为______,H物质的名称为______.
(2)G→J的化学方程式为______.
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):______.
(4)E与碳形成的合金在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:______.
(5)写出一个满足下列两个条件的置换反应方程式:______.
①在A--J中选一种单质作为反应物;
②生成物之一是具有磁性的氧化物.
参考答案:D是一种红棕色固体,应为Fe2O3,可与C反应,生成物A既可与盐酸反应,又可与NaOH反应,由转化关系可知C为Al,A为Al2O3,E为Fe,B为O2,H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,
(1)由以上分析可知B为O2,H为偏铝酸钠,故答案为:O2;偏铝酸钠;
(2)G为Fe(OH)2,不稳定,具有还原性,可与空气中氧气发生氧化还原反应生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2═4Fe(OH)3;
(3)D为Fe2O3,与盐酸反应生成FeCl3,其强酸弱碱盐,水解呈酸性,离子方程式为Fe3++3H2O

Fe(OH)3+3H+,
故答案为:Fe3++3H2O

?Fe(OH)3+3H+;
(4)Fe与碳形成的合金在潮湿的空气中易发生电化学腐蚀,为吸氧腐蚀,其正极的电极反应式为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(5)生成物之一是具有磁性的氧化物,应为Fe3O4,应为铁和水蒸气的反应,反应的化学方程式为3Fe+4H2O(g)?△?.?Fe3O4+4H2↑,
故答案为:3Fe+4H2O(g)?△?.?Fe3O4+4H2↑.
本题解析:
本题难度:一般
5、简答题 下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一.
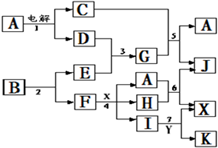
请按要求填空:
(1)写出下列物质的化学式
A?、E?、F?、K?;
(2)写出反应5的化学方程式?
(3)1molB通过反应2得到1molF,B中F的质量分数为72%,则B的化学式为?.
(4)写出反应4的离子方程式?.
参考答案:A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应5是工业制X的主要反应之一,则X为硝酸,反应5为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应4为Ag与硝酸的反应,(1)由上述推断可知A为H2O,E为N2,F为Ag,K为AgCl,故答案为:H2O;N2;Ag;AgCl;
(2)反应5为氨气的催化氧化反应,氨气与氧气反应生成一氧化氮和水,反应的方程式为4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)1molB通过反应2得到1molF,设B的化学式为AgNx,则108108+14x×100%=72%,解得x=3,所以B的化学式为AgN3,故答案为:AgN3;?
(4)反应4为Ag与硝酸的反应,结合反应6可知,Ag与硝酸反应生成NO2,离子反应为Ag+2H++NO3-═Ag++NO2↑+H2O,故答案为:Ag+2H++NO3-═Ag++NO2↑+H2O.
本题解析:
本题难度:一般