1、填空题 (创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s
c/(mol·L-1)
| 0
| 20
| 40
| 60
| 80
| 100
|
c(N2O4)/(mol·L-1)
| 0.100
| a
| 0.5b
| 0.4b
| ?
| ?
|
c(NO2)/(mol·L-1)
| 0
| 0.060
| b
| c1
| c2
| c3
|
?
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
参考答案:(1)①0.070 1.5×10-3 ②b<c1=c2(或c1=c2>b) 0.120 60% (2)①K=c(H4SiO4) ②正方向 由于固体、液体都会受到大气压强的影响,故此时K的表达式应为K=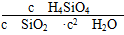 ,增大压强时,平衡向正反应方向移动
,增大压强时,平衡向正反应方向移动
本题解析:(1)根据表中数据和反应方程式可得(0.100-a)∶0.060=1∶2,解得a=0.070;由(0.100-0.5b)∶b=1∶2,解得b=0.100;由(0.100-0.4b)∶c1=1∶2,解得c1=0.120,此时 =0.36,即第60 s时反应已达平衡状态。
=0.36,即第60 s时反应已达平衡状态。
(2)①由于情境陌生,在书写化学平衡常数K的表达式时容易把水和二氧化硅写上。仔细审题会发现二氧化硅是固体,由于H4SiO4溶液的浓度很小,水的浓度可看成常数,故K=c(H4SiO4)。
②压强增大,分析平衡移动的方向,注意在压强很大的条件下,此时压强对固体、液体的影响不能忽略不计。
本题难度:一般
2、选择题 一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是(?)
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是(?)
A.平衡向正反应方向移动
B.x+y<z
C.C的体积分数降低
D.B的转化率提高
参考答案:C
本题解析:恒温扩大体积则气体的压强减小,平衡向气体总体积增大的方向移动。因原平衡时A的浓度为0.5 mol·L-1,当体积扩大两倍,假设平衡不移动,则A的浓度将变为0.25 mol·L-1,现新平衡时A的浓度为0.3 mol·L-1,说明平衡向生成A的方向移动了,即平衡向逆反应方向移动,所以x+y>z,则C的体积分数降低。
本题难度:简单
3、简答题 在其他条件相同时,增大反应物的浓度,化学反应速率______;减小反应物浓度,化学反应速率______.
参考答案:在其他条件相同时,增大反应物的浓度,单位体积的活化分子数增多,有效碰撞的几率,化学反应速率增大,减小反应物浓度,反应速率减小,
故答案为:增大;减小.
本题解析:
本题难度:一般
4、选择题 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
 bZ(g)?△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g)?△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是

A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
B.化学方程式中a:b= 1:3,
C.推测在第7min时曲线变化的原因可能是增加X的浓度
D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后
参考答案:D
本题解析:A、0~10min内v(X)=  ?=0.025mol/(L?min),故A错误;B、物质的量变化量之比等于化学计量数之比,方程式中a:b=(0.45-0.2):(0.50-0)=1:2,故B错误;C、第7min时,X的浓度减小 ,故不可能是增加X的浓度,C错误;D、第10min--13min及第20min 后X、Z的浓度不变,处于平衡状态,D正确。
?=0.025mol/(L?min),故A错误;B、物质的量变化量之比等于化学计量数之比,方程式中a:b=(0.45-0.2):(0.50-0)=1:2,故B错误;C、第7min时,X的浓度减小 ,故不可能是增加X的浓度,C错误;D、第10min--13min及第20min 后X、Z的浓度不变,处于平衡状态,D正确。
本题难度:一般
5、选择题 在氨水中存在?NH3·H2O? NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入
NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入
A.氯化铵固体
B.硫酸
C.NaOH固体
D.大量水
参考答案:C
本题解析:考查外界条件多平衡的影响。A是增大NH4+浓度,平衡向逆反应方向移动,但c(OH-),A不正确。硫酸中和OH-,促进电离,B不正确。C中是增大c(OH-),平衡向逆反应方向移动,正确。稀释促进电离,D不正确,答案选C。
本题难度:简单