1、计算题 (6分)有一硫酸与硝酸的混合溶液,取出10ml加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g沉淀;滤液与4.0mol/LNaOH溶液反应用去20ml碱液时,恰好完全中和。
试求:
(1)原混和液中H2SO4、HNO3的物质的量浓度各为多少?
(2)另取10ml原混和液, 加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
参考答案:(6分)(1)c(H2SO4)=2mol/L (2分)? c(HNO3)=4mol/L?(2分)
(2)448mL(2分 )w.&@m
)w.&@m
本题解析:略
本题难度:一般
2、简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
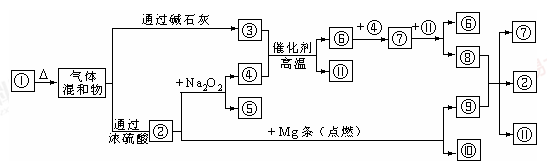
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为?;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是?。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式?。
参考答案:(1)(NH4)2CO3或NH4HCO3? O2
(2)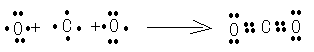
(3)C+4HNO3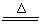 4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
(4)3Mg+8H++2NO3-=3Mg2++2NO↑+4H2O
本题解析:由②+Mg→⑨+⑩,想到中学化学的典型反应CO2+2Mg=C+2MgO知②为CO2为突破口,由②+Na2O2→④+⑤,且②为CO2,推断知④、⑤为Na2CO3和O2,由③+④ ⑥+
⑥+ ?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
本题难度:一般
3、选择题 NH3是重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是

A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以发生水解反应
参考答案:C
本题解析:A、NH4Cl是氮肥,NaHCO3不是化肥,错误;B、NH4Cl、HNO3受热时都易分解,Na2CO3受热时不分解,错误;C、NO2跟NH3可以发生反应:6NO2+8NH3=7N2+12H2O,该反应为氧化还原反应,正确;D、NaCl是强酸强碱盐不发生水解,错误。
本题难度:一般
4、选择题 锌与稀硝酸反应时,当1mol硝酸参加反应就有0.8mol电子转移,此时硝酸的还原产物可能是(双选)……( )
A.NO
B.N2O
C.N2
D.NH4NO3
参考答案:B、D
本题解析:先计算参加反应的Zn的物质的量,然后计算出表现酸性的硝酸的物质的量和表现氧化性的硝酸的物质的量即可得出答案。转移0.8mol电子需0.4molZn,生成0.4molZn(NO3)2,在此表现酸性的硝酸为0.8mol,则得0.8mol电子的硝酸为0.2mol,则有如下两种情况:
(1)N(+Ⅴ)→N(+Ⅰ),每摩HNO3得4摩电子,0.2molHNO3都参加氧化还原反应,还原产物为N2O;
(2)N(+Ⅴ)→N(-Ⅲ),每摩HNO3得8摩电子,0.1molHNO3参加氧化还原反应即可,还原产物为NH4NO3
故答案为B、D。
本题难度:简单
5、填空题 硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
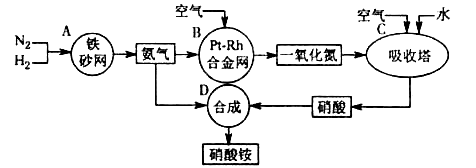
⑴写出反应容器B中发生反应的化学方程式:?。
⑵吸收塔C中通入空气的目的是?;C、D两个反应容器中发生的反应,属于氧化还原反应的是?(填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:?。?
⑷金属铜与稀硝酸反应的离子方程式是?,该反应中稀硝酸表现的性质是?。
参考答案:⑴4NH3+5O2 4NO+6H2O?⑵将一氧化氮氧化成二氧化氮?;? C?
4NO+6H2O?⑵将一氧化氮氧化成二氧化氮?;? C?
⑶4HNO3 4NO2↑+O2↑+2H2O?⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O?酸性和氧化性
4NO2↑+O2↑+2H2O?⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O?酸性和氧化性
本题解析:氮气与氢气在铁触媒的作用下反应产生氨气,氨气在Pt-Rh合金作用下加热被空气中的氧气氧化为NO和水,NO在吸收塔中与氧气反应产生二氧化氮气体,二氧化氮被水吸收得到硝酸和NO。硝酸与氨气作用形成硝酸铵。⑴反应容器B中发生反应的化学方程式为4NH3+5O2 4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3
4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3 4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O?其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O?其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
本题难度:一般