1、计算题 (6分)有一硫酸与硝酸的混合溶液,取出10ml加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g沉淀;滤液与4.0mol/LNaOH溶液反应用去20ml碱液时,恰好完全中和。
试求:
(1)原混和液中H2SO4、HNO3的物质的量浓度各为多少?
(2)另取10ml原混和液, 加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
2、简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
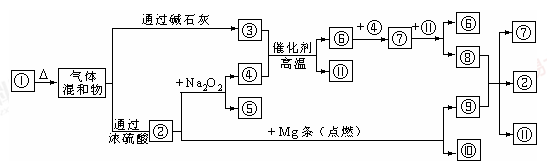
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为?;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是?。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式?。
3、选择题 NH3是重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是

A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以发生水解反应
4、选择题 锌与稀硝酸反应时,当1mol硝酸参加反应就有0.8mol电子转移,此时硝酸的还原产物可能是(双选)……( )
A.NO
B.N2O
C.N2
D.NH4NO3
5、填空题 硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
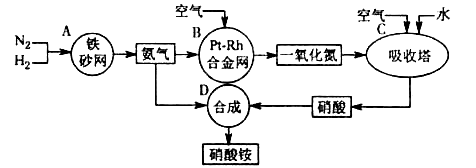
⑴写出反应容器B中发生反应的化学方程式:?。
⑵吸收塔C中通入空气的目的是?;C、D两个反应容器中发生的反应,属于氧化还原反应的是?(填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:?。?
⑷金属铜与稀硝酸反应的离子方程式是?,该反应中稀硝酸表现的性质是?。