1、填空题 (14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为?。
(2)上述反应中产生的气体可用?吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为?L。若准确测得的实际体积小于理论值(计算值),请分析可能原因?。
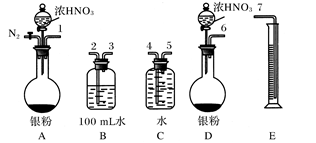
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
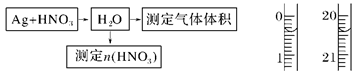
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为?。
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中?(填“有”或“没有”)NO产生,作此判断的依据是?。
参考答案:(1)1:1?(2)氢氧化钠(或硫酸铜)溶液
(3)112L?部分NO2转化为N2O4使体积减小(或其它合理答案)
(4)①0.008 mol?②有?因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
本题解析:(1)As由+3降为+2,Sn由+2升为+4,根据得失电子总数相等,As2S3和SnCl2的物质的量之比为1:1。
(2)反应中氧化剂是As2S3,生成的H2S气体可用NaOH溶液(或其它碱溶液)或硫酸铜溶液吸收。
(3)由反应式可知3×32gS对应标准状况下10×22.4LNO2,若生成48g S,则生成标准状况下的NO2的体积为112L;
由于存在可逆反应2NO2 N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值
N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值
(4)实验装置图为:

①消耗的NaOH溶液的体积为20.40—0.40=20.00ml,则硝酸的浓度为:c(HNO3)×25=0.1×20,c(HNO3)=0.08mol/L;
则在B容器中生成硝酸的物质的量为0.08×0.1=0.008mol
②由反应3NO2+H2O=2HNO3+NO可知,当生成0.008molHNO3时,生成的NO的体积为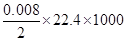 =89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
=89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
本题难度:一般
2、填空题 现有物质A、B、C、D、E、F、G、H、M、N,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示的变化(其他有关反应条件均略去)。试完成下列问题:

(1)写出C、D、H的化学式___________、___________、___________。
(2)写出反应①②③的化学方程式:
①_______________________________________________,
②_______________________________________________,
③_______________________________________________。
参考答案:(1)Fe? NO? Mg
(2)①C+4HNO3(浓)====CO2↑+4NO2↑+2H2O
②3Fe(NO3)2+4HNO3====3Fe(NO3)3+NO↑+2H2O
③CO2+2Mg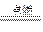 2MgO+C
2MgO+C
本题解析:首先推断出各物质分别是:M是碳(C),N是HNO3,A是CO2和NO2的混合气体,B是稀HNO3,C是Fe,D是NO,E是Fe(NO3)2,F是Fe(NO3)3,G是CO2,H是Mg。
本题难度:简单
3、实验题 某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
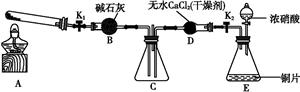
(1)E装置中制取NO2反应的化学方程式是? 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 ?。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ ?。
(4)此实验装置存在一个明显的缺陷是?。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是 ?。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
参考答案:(1)Cu+4HNO3 (浓) Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O
(2)C装置中混合气体颜色变浅
(3)在此条件下,该反应的化学反应速率极慢
(4)缺少尾气吸收装置
(5)NO2能被Na2O2还原
(6)①EDBF ②2NO2+Na2O2 2NaNO3
2NaNO3
本题解析:(1)浓硝酸在加热条件下与铜片反应制取NO2:Cu+4HNO3 (浓) Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
(2)由于NO2气体是红棕色的,若NO2能够被NH3还原,随NO2的消耗,气体颜色会变浅。
(3)①从反应能否发生角度作出假设;②从化学平衡角度作了假设;③可以从反应速率作出假设,也可能是二者反应速率极慢,短时间内无法观察到气体颜色的变化。
(4)NO2与NH3都是有毒气体,即使二者能够发生反应,也会反应不完全,剩余气体逸散到空气中造成污染。应该增加尾气处理装置。
(5)由于Na2O2中的氧元素处于-1价,既有氧化性,也有还原性,所以NO2也可能被Na2O2还原。
(6)①整个实验的设计原理为:利用E制取NO2气体,通过D装置进行干燥,然后进入B装置进行验证实验,最后通过F装置吸收未反应的NO2气体,所以装置的连接顺序是EDBF。
②白色物质为纯净物,且无其他物质生成,只可能是NO2被氧化为了N2O5,与生成的Na2O化合为了NaNO3。
本题难度:困难
4、选择题 在某100 mL混合溶液中,HNO3和H2SO4的物质的量浓度分别为0.400 mol·L-1和0.100 mol·L-1,向该混合溶液中加入1.92 g铜粉,加热使其充分反应,若反应前后溶液体积视作不变,反应后溶液中Cu2+的物质的量浓度为(?)
A.0.15 mol·L-1
B.0.225 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
参考答案:B
本题解析:溶液中n(H+)="0.1" L×0.4 mol·L-1+0.1 L×0.1 mol·L-1×2="0.06" mol
n(Cu)=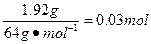
n(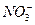 )="0.1" L×0.4 mol·L-1="0.04" mol
)="0.1" L×0.4 mol·L-1="0.04" mol
3Cu? +? 8H++? 2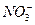 ====3Cu2++2NO↑+4H2O
====3Cu2++2NO↑+4H2O
0.03 mol? 0.06 mol? 0.04 mol
因n(H+)不足,故只消耗Cu: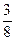 ×0.06="0.0225" mol
×0.06="0.0225" mol
c(Cu2+)=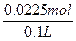 ="0.225" mol·L-1
="0.225" mol·L-1
本题难度:简单
5、实验题 图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
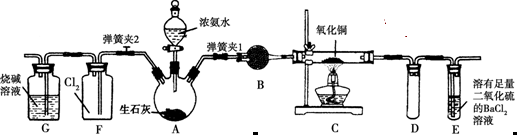
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先___?_____,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
参考答案:
(1)关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1(2分)
(2)碱石灰(或生石灰) (2分)
(3)白色沉淀(2分) ? 2NH3+3CuO 3Cu+N2↑+3H2O(2分)
3Cu+N2↑+3H2O(2分)
(4)3Cl2+8NH3=N2+6NH4Cl(2分)
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,瓶内压强减小,溶液倒吸(2分)
本题解析:(1)检查装置的气密性的首要前提是形成封闭的体系,所以要先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹;(2)B是干燥NH3的装置,干燥NH3需使用碱性干燥剂,可以使用碱石灰;(3) C中CuO与NH3发生氧化还原反应生成红色的Cu、N2和H2O ,反反应的方程式为:2NH3+3CuO 3Cu+N2↑+3H2O;E是处理NH3的尾气装置,E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl,所以现象是产生白色沉淀;(4)关闭弹簧夹1后,打开弹簧夹2,Cl2可将NH3氧化为N2,同时生成的HCl会和NH3反应生成NH4Cl,产生白烟现象,F瓶内压强变小从而出现倒吸现象。
3Cu+N2↑+3H2O;E是处理NH3的尾气装置,E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl,所以现象是产生白色沉淀;(4)关闭弹簧夹1后,打开弹簧夹2,Cl2可将NH3氧化为N2,同时生成的HCl会和NH3反应生成NH4Cl,产生白烟现象,F瓶内压强变小从而出现倒吸现象。
本题难度:一般