1、选择题 下列变化不可能通过一步实验直接完成的是
[? ]
A.Al(OH)3 → Al2O3
B.Al2O3 → Al(OH)3
C.Al → Al3+
D.Al3+ → Al(OH)3
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列关于铝的叙述中,正确的是(?)
A.铝是一种比较活泼的金属
B.在常温下,铝不能与氧气反应
C.在化学反应中铝容易得电子,是氧化剂
D.宜用铝制餐具蒸煮酸性、碱性或咸的食物
参考答案:A
本题解析:A铝金属性较强,故化学性质比较活泼。A正确。
B.铝在空气中易被氧气氧化成氧化铝。B错误。
C.铝在反应中易失去电子,做还原剂。C错误。
D.铝既可与酸反应生 成氢气,也与碱反应,在盐溶液中还易形成原电池发生电化学腐蚀。故不宜用铝制餐具蒸煮酸性、碱性或咸的食物。
故选A。
点评:掌握铝的化学性质(还原性强,较活泼),解决此题不难。
本题难度:一般
3、选择题 一定质量的镁条分别与相同条件下的相同体积的①氧气、②氮气、③二氧化碳中充分燃烧,所得固体物质的质量大小排列顺序正确的是
A.②>③>①
B.③>②>①
C.②>①>③
D.③>①>②
参考答案:A
本题解析:镁在三种物质反应的化学方程式分别是2Mg+O2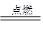 2MgO、3Mg+N2
2MgO、3Mg+N2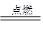 Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2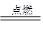 2MgO+C。所以根据反应的化学方程式可知,如果参加反应的气体都是1mol,则所得固体物质的质量大小排列顺序正确的是②>③>①,答案选A。
2MgO+C。所以根据反应的化学方程式可知,如果参加反应的气体都是1mol,则所得固体物质的质量大小排列顺序正确的是②>③>①,答案选A。
点评:该题的根据是准确写出反应的化学方程式,然后根据生成的固体物质计算即可。
本题难度:一般
4、选择题 进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
[? ]
A.SO2气体通入溴水(橙红色)褪色,表现了SO2的漂白性;足量的二氧化硫通入紫色石蕊试液中先变红后褪色,因为生成酸使其变红,又因为SO2的漂白性,使其褪色
B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应
D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜
参考答案:B
本题解析:
本题难度:简单
5、选择题 11.9gMg、Al、Fe组成的合金溶解于足量的NaOH溶液,合金质量减少2.7g,另取等质量的合金溶解于足量的硝酸中,反应后产生标准状况下的6.72LNO,向所得溶液中加入适量的NaOH溶液恰好使金属离子转化为沉淀,则沉淀为(?)g
A.22.1
B.27.2
C.30
D.14.6
参考答案:B
本题解析:将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量为6.72L/(22.4L/mol)×3=0.9mol,反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,所以反应后沉淀的质量等于11.9g+0.9mol×17g/mol=27.2g,故选B。
点评:本题如果利用化学方程式一步一步计算得话,将会有很大的计算量,所以可以利用最后的电荷守恒来计算,这是解题技巧之一。
本题难度:简单