1、选择题 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比为
A.3:2
B.2:3
C.1:3
D.1:1
参考答案:D
本题解析:由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是相等的,生成氢气的体积比为1:1,答案选D。
本题难度:一般
2、选择题 铝制品不宜长期盛放酸性食品和碱性食品是因为铝制品表层属于
[? ]
A.金属铝
B.碱性氧化物
C.酸性氧化物
D.两性氧化物
参考答案:D
本题解析:
本题难度:简单
3、选择题 把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍 为a g,则此合金中铝的质量分数为(?)
为a g,则此合金中铝的质量分数为(?)
A.70%
B.30%
C.52.4%
D.22.2%
参考答案:B
本题解析:略
本题难度:简单
4、选择题 把铝粉和Fe3O4粉末配成铝热剂并分成两份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应。前后两种情况下生成的气体在相同状况下的体积比是(? )
A.3∶4
B.4∶3
C.3∶8
D.8∶3
参考答案:A
本题解析:当Al粉与Fe3O4在高温下恰好完全反应时,物质的量之比为8∶3,即8Al+3Fe3O4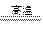 ?
?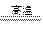 9Fe+4Al2O3
9Fe+4Al2O3
Fe+2HCl====FeCl2+H2↑
9 mol? 9 mol
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
8 mol? 12 mol
两种情况下产生氢气的体积比为3∶4。
本题难度:简单
5、实验题 (1)(4分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。三硅酸镁的氧化物形式为?,某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径?(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:??
(2)(2分) Al2O3、MgO和SiO2都可以制耐火材料,其原因是?。
a.Al2O3、MgO和SiO2都不溶于水? b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 ?d.Al2O3、MgO和SiO2都有很高的熔点
(3)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
①(4分)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,要填写):

②(2分))向盛有KI溶液滴加氯水的整个过程中的还原剂是?。
③(2分)把KI换成KBr,则CCl4层变为红棕色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是?。
④(2分)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若将KI与Cl2反应制KIO3,至少需要消耗Cl2?L(标准状况,保留2位小数)。
参考答案:(1)2MgO.3SiO2.nH2O(1分);大(1分);Al(OH)3+OH-=AlO2-+2H2O(2分);
(2) a d (2分)
(3)①I2+5Cl2+6H2O→2HIO3+10HCl;(4分)
②KI、I2;(2分)
③HBrO3>Cl2>HIO3;(2分)
④10.58L。(2分)
本题解析:略
本题难度:一般