1、选择题 下列有关试剂的保存方法,错误的是(? )
A.浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B.少量的金属钠保存在煤油中
C.液溴应保存在棕色细口瓶,并加水液封
D.新制的氯水通常保存在无色玻璃试剂瓶中
2、填空题 粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质。工业上以粗氧化锌生产硫酸锌晶体(ZnSO4·7H2O)的工艺流程如下图所示:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
请回答下列问题:
(1)操作③的名称是?;
(2)加入适量锌粉的作用为?;
(3)加入30%H2O2反应的离子方程式是?;
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ? ,Ca(OH)2不能过量的原因是 ? 。
3、选择题 容量瓶是用来配制物质的量浓度溶液的定量仪器,其外壁上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的(? )
A.①③⑤
B.③⑤⑥
C.①②④
D.②④⑥
4、实验题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
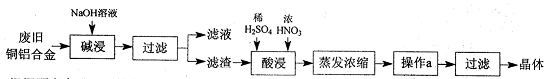
根据题意完成下列填空:
(1)“碱浸”的目的是?,写出有关的离子方程式?。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有?。
(3)操作a的名称为?,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为?。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为?;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用?。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式?。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点?。
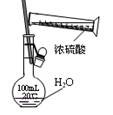
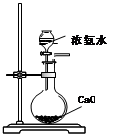
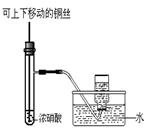
5、选择题 下列实验合理的是?
?
| 
| 
| 
|
A.配制一定浓度硫酸
| B.制备少量氨气
| ? C.制备并收集少量NO2气体
| ? D.制备少量氧气
|
?