1、选择题 实验是化学研究的基础。下列关于各实验装置的叙述不正确的是
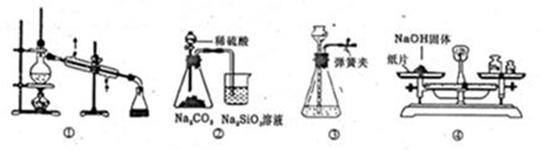
A.装置①可用于乙醇与水的分离
B.装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气
D.图④装置可用来称量一定质量的NaOH固体
参考答案:D
本题解析:A、乙醇与水互溶,但二者的沸点相差较大, 可以用蒸馏的方法分离,A正确;B、稀硫酸与碳酸钠反应生成CO2,CO2通入到硅酸钠溶液中,生成白色沉淀硅酸,所以装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱,B正确;C、装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变,能说明装置不漏气,C正确;D、氢氧化钠具有吸水性和腐蚀性,用托盘天平称量时,应该非在烧杯中称量,D不正确,答案选D。
本题难度:一般
2、选择题 “细节决定成败”,对于下列实验细节处理正确是
A.配制FeCl3(aq):称取一定质量的FeCl3(s),加水溶解,再加入稀盐酸酸化
B.钠与水的反应:取绿豆大小的金属钠放入烧杯,再滴入两滴酚酞试液,最后加入水
C.析出溶质晶体:接近饱和的热溶液,冷却速度越慢得到的晶体颗粒越大
D.实验室制氢气:为了加快反应速率,向稀H2SO4中滴加少量Cu(NO3)2(aq)
参考答案:C
本题解析:? A.配制FeCl3(aq):称取一定质量的FeCl3(s),溶于浓盐酸中再加水稀释到所要的浓度;B.钠与水的反应:烧杯中加入适量蒸馏水,再滴入两滴酚酞试液,取绿豆大小的金属钠放入烧杯;D.实验室制氢气:为了加快反应速率,向稀H2SO4中滴加少量Cu(SO4)2(aq) ,形成原电池加快化学反应速率,加入硝酸铜将不再产生氢气。
本题难度:一般
3、选择题 下列对一些实验事实的理论解释正确的是
选项
| 实验事实
| 理论解释
|
A
| 氟化氢的沸点高于氯化氢
| HF分子间存在氢键,而HCl分子间几乎不存在氢键
|
B
| 将SO2气体通入氯水中,氯水褪色
| SO2具有漂白性
|
C
| MgCl2溶液中加入浓氨水,出现白色沉淀
| 碱性:NH3·H2O > Mg(OH)2
|
D
| 用pH试纸测得CH3COONH4溶液的pH=7
| CH3COONH4不能水解
参考答案:AC
本题解析:A:正确
B:在反应中SO2表现还原性:Cl2+SO2+2H2O=2HCl+H2SO4
C:正确
D:CH3COONH4溶液的pH=7是由于CH3COO—与NH4+水解的程度相当,最终溶解仍呈中性,不正确
本题难度:简单
4、实验题 (4分)下列实验操作或对实验事实的描述中正确的说法有?。
①分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③实验室用二氧化锰和稀盐酸制备氯气
④只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤用分液法分离苯和硝基苯的混合物
参考答案:①④
本题解析:乙烯能被酸性高锰酸钾溶液氧化生成CO2,因此应该用溴水除去乙烯,②不正确。实验室用二氧化锰和浓盐酸制备氯气,③不正确。溴水额苯,四氯化碳发生萃取,有机层分别在上层和下层。溴水和乙醇互溶,溴水和己烯发生加成反应,所以④正确。苯和硝基苯是易溶的,不能直接分液,⑤不正确,所以正确的答案选①④。
本题难度:简单
5、选择题 下列实验可行的是
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用胶头滴管滴加少量液体
D.用乙醇从碘水中萃取碘
参考答案:AC
本题解析:A正确,根据较活泼的金属置换较不活泼的金属;B错,CO2与HCl气体均能与NaOH溶液反应;C正确,取用少量液体用胶头滴管;D错,乙醇不能作为萃取剂;
本题难度:简单
|