1、选择题 等质量、等溶质质量分数的稀盐酸和稀硫酸,分别与足量的铁、铝反应,按上述顺序得到氢气的质量比是
A.1:1
B.1:3
C.98:73
D.73:49
参考答案:C
本题解析:足量的铁、铝说明酸完全反应,学生很容易参照例1而选A,忽略了酸中溶质的不同。等质量、等溶质质量分数的稀盐酸和稀硫酸,说明其中含有的溶质HCl和H2SO4质量是相等的,HCl和H2SO4又完全反应,所以生成氢气的质量比应等于HCl和H2SO4中所含氢元素的质量比。可设溶质HCl和H2SO4质量均为m,质量分数n,则得到氢气的质量比为:2×m×n÷36.5 :2×m×n÷98 ="?" 98 : 73。
本题难度:困难
2、选择题 有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀HNO3,充分振荡后仍有白色沉淀,对此实验下列结论正确的是
A.Na2SO3已部分氧化
B.加入硝酸钡溶液生成的沉淀一定含BaSO4
C.加入HNO3后的不溶沉淀一定为BaSO3
D.此实验不能确定Na2SO3是否部分氧化
参考答案:D
本题解析:
本题难度:一般
3、选择题 27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L?H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol?L-1?NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
A.4mol?L-1
B.3mol?L-1
C.2mol?L-1
D.1mol?L-1
参考答案:D
本题解析:分析:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4),据此计算硫酸的物质的量,最终求出原硫酸的物质的量浓度.
解答:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据钠离子守恒有:
n(NaOH)=2n(Na2SO4),
根据硫酸根守恒有n(H2SO4)=n(Na2SO4)= n(NaOH)=
n(NaOH)= ×0.5L×2mol/L=0.5mol,
×0.5L×2mol/L=0.5mol,
所以原硫酸的物质的量浓度为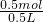 =1mol/L.
=1mol/L.
故选D.
点评:本题涉及的化学反应比较多,计算过程也很复杂,用守恒法计算,不但思路清楚,而且解题简单.
本题难度:一般
4、选择题 下列物质中,不属于合金的
A.青铜
B.黄铜
C.钢铁
D.水银
参考答案:D
本题解析:答案:D
水银是单质。A. 青铜原指铜锡合金﹐后除黄铜﹑白铜以外的铜合金均称青铜﹐并常在青铜名字前冠以第一主要添加元素的名? B. 黄铜是由铜和锌所组成的合金。如果只是由铜、锌组成的黄铜就叫作普通黄铜。黄铜常被用于制造阀门、水管、空调内外机连接管和散热器等。C. 钢铁 ,铁和碳的合金
本题难度:困难
5、选择题 既能与盐酸反应又能与NaOH溶液反应的一组物质是
①Al?②(NH4)2CO3?③氨基酸?④油脂.
A.②④
B.①②
C.①②③
D.①②③④
参考答案:D
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:①Al是两性元素和强酸盐酸,强碱氢氧化钠溶液反应,故①符合;
②(NH4)2CO3 和盐酸反应生成二氧化碳气体,和氢氧化钠溶液反应生成氨气,故②符合;
③氨基酸是两性物质和盐酸、氢氧化钠反应,故③符合;
④油脂是酯类,在氢氧化钠溶液中水解反应,在盐酸中水解反应,故④符合;
故选D.
点评:本题考查元素化合物的性质,题目难度不大,旨在考查学生对知识的理解识记与知识归纳,注意基础知识的积累.
本题难度:简单