1、选择题 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
A.①②③④
B.①②③
C.①③④
D.②④
参考答案:A
本题解析:分析:①利用铜及其化合物的性质来分析上述转化;
②利用钠的化合物的性质来分析上述转化;
③利用二氧化硫及其化合物的性质来分析上述转化;
④利用铝的化合物的两性及转化和常见反应来分析转化.
解答:①铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜,硫酸铜与硝酸钡反应生成硝酸铜,铜和浓硫酸反应可生成硫酸铜,再利用较活泼金属与不活泼金属的盐溶液发生的置换反应可实现丙→甲、丁→甲的反应,故①能实现转化;
②碳酸钠和氢氧化钙反应生成氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸氢钠,碳酸氢钠分解或与盐酸反应生成二氧化碳,二氧化碳与氢氧化钠能反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠,故②能实现转化;
③(NH4)2SO3和氯化钙反应生成亚硫酸钙沉淀,亚硫酸钙和盐酸反应生成二氧化硫,过量的二氧化硫和一水合氨反应生成亚硫酸氢铵,故③能实现转化;
④氢氧化铝受热分解生成氧化铝,氧化铝和氢氧化钠反应生成偏铝酸钠,偏铝酸钠和过量的盐酸反应生成氯化铝,故④能实现转化;
故选A.
点评:本题考查物质的转化,明确物质的性质及发生的化学反应是解答本题的关键,本题中③发生的几个氧化还原反应是学生解答的难点.
本题难度:困难
2、选择题 氢氧化铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解25.25g上述混合物,恰好消耗1.0?mol?L-1?盐酸500mL.灼烧等量的上述混合物,得到的氧化铜质量为
A.15?g
B.20?g
C.30?g
D.35?g
参考答案:B
本题解析:分析:混合物与盐酸恰好反应生成CuCl2,根据氯元素守恒计算CuCl2的物质的量,根据铜元素守恒计算混合物灼烧生成CuO的物质的量,再根据m=nM计算氧化铜的质量.
解答:混合物与盐酸恰好反应生成CuCl2,根据氯元素守恒可知n(CuCl2)=0.5L×1mol/L× =0.25mol,
=0.25mol,
根据Cu元素质量守恒可知,n(CuO)=n(CuCl2)=0.25mol,
故m(CuO)=0.25mol×80g/mol=20g,
故选B.
点评:本题考查混合物的有关计算,难度中等,关键在于利用守恒思想进行解答.
本题难度:困难
3、选择题 下列关于Fe2+和Fe3+的叙述中,错误的是
A.Fe2+的水溶液为浅绿色
B.Fe2+既有氧化性,又有还原性
C.Fe3+的水溶液为黄色
D.Fe3+溶液中滴入SCN-,立即出现红色沉淀
参考答案:D
本题解析:分析:根据常见离子的颜色判断A、C选项;根据化合价的高低判断氧化性、还原性来确定B选项;根据Fe3+与SCN-反应现象判断D选项,
解答:A:中学常见水溶液有颜色离子有:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色),故A对.
B:氧化性是指物质得电子的性质,还原性是指物质失电子的性质,元素处于最高价态时,只表现为氧化性,元素处于最低价态时,只表现为还原性,处于中间价态,既表现氧化性,又表现还原性.如:H2O中H为+1价(最高价态),表现为氧化性,O为-2价(最低价态),表现为还原性,所以H2O既有氧化性,又有还原性;Fe2+处于中间价态,既能得电子,又能失电子,所以既有氧化性,又有还原性.故B对.
C:由A知Fe3+的水溶液为黄色,故C对.
D:Fe3+溶液中滴入SCN-,溶液呈红色,不会出现红色沉淀,类似的有Fe(OH)3胶体,呈红褐色.故D错.
故选D
点评:1、中学常见水溶液有颜色离子有:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色),
2、氧化性、还原性的判断:最高价态的元素只有氧化性,最低价态元素只有还原性,中间价态的既有氧化性又有还原性.
本题难度:简单
4、选择题 铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有
A.两性
B.良好导电性
C.熔点低
D.还原性,在反应中放出大量热
参考答案:D
本题解析:铝是活泼的金属,且在反应中会放出大量的热,所以选项D正确,其余都是错误的,答案选D。
本题难度:一般
5、选择题 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲瓶中加入少量的NaHCO3晶体,在乙瓶中加入少量的NaHSO3晶体,丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙
B.甲>丙>乙
C.丙>甲=乙
D.乙>丙>甲
参考答案:B
本题解析:氯水中存在平衡Cl2+H2O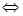 HCl+HClO。甲:加入少量的NaHCO3晶体,会消耗盐酸,使平衡正向移动,HClO的物质的量浓度增大;乙:加入少量的NaHSO3晶体,会被HClO氧化,使HClO的物质的量浓度减小。丙:HClO的物质的量浓度不变。故HClO的物质的量浓度排序:甲>丙>乙。
HCl+HClO。甲:加入少量的NaHCO3晶体,会消耗盐酸,使平衡正向移动,HClO的物质的量浓度增大;乙:加入少量的NaHSO3晶体,会被HClO氧化,使HClO的物质的量浓度减小。丙:HClO的物质的量浓度不变。故HClO的物质的量浓度排序:甲>丙>乙。
故选B
本题难度:简单