1、选择题 根据化学反应实质是旧键的断裂和新键的形成过程,下列变化不属于化学变化的是
A.白磷在隔绝空气的条件下,在260℃转化为红磷
B.石墨在高温高压下转化为金刚石
C.干冰转化为CO2气体
D.固态S8加热到444.6℃时变成硫蒸气S2
参考答案:C
本题解析:考查化学变化的实质及判断。干冰转化为CO2气体上物理变化,破坏的是分子间作用力,而化学键不变,其余都是化学变化,答案选C。
本题难度:简单
2、填空题 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s)? ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+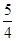 O2(g)===
O2(g)=== P4O10(s)? ΔH2=-738.5 kJ·mol-1
P4O10(s)? ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为?。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)? ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为?,反应过程中放出的热量为?。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
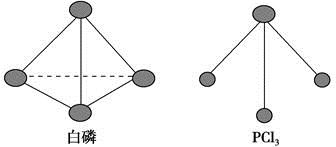
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=?。
参考答案:(1)P4(s,白磷)===4P(s,红磷)? ΔH=-29.2 kJ·mol-1
(2)3∶1 1323.45 kJ(3)-1326 kJ·mol-1
本题解析:(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。
(2)n(白磷)=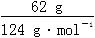 =0.5 mol,n(O2)=
=0.5 mol,n(O2)= =2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
=2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
x+y=0.5,5x+3y=2.25,
解得x=0.375 mol,y=0.125。
反应过程中放出的热量为:2983.2 kJ·mol-1×0.375 kJ·mol-1+1638 kJ·mol-1×0.125 mol=1323.45 kJ。
(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198? kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1326 kJ·mol-1。
本题难度:一般
3、选择题 下列说法中,不正确的是?(?)?
A.焓变为正值的反应都是吸热反应
B.放热的熵增加反应一定能自发进行
C.同一条件下,氨水在物质的量浓度不同的溶液中,其电离程度是不相同的
D.强电解质都是离子化合物,弱电解质都是共价化合物
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列说法或表示法正确的是(?)
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.由C(石墨)→C(金刚石) ΔH =" +119" kJ·mol—1可知,石墨比金刚石稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)===2H2O(l) ΔH =" +285.8" kJ· mol—1
D.在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧热相等
参考答案:BD
本题解析:略
本题难度:简单
5、选择题 在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
?
| 10 min
| 20 min
| 30 min
| 40 min
| 50 min
| 60 min
|
300℃
| 0.080
| 0.120
| 0.150
| 0.168
| 0.180
| 0.180
|
500℃
| 0.120
| 0.150
| 0.156
| 0.160
| 0.160
| 0.160
|
?下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)="0.003" mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
参考答案:D
本题解析:A、300℃平衡时甲醇的物质的量大于500℃平衡时甲醇的物质的量,所以升高温度平衡逆向移动,正向是放热反应,ΔH<0,错误;B、300℃时,前20 min内甲醇的物质的量增加0.120mol,则氢气的物质的量减少0.240mol,浓度改变0.120mol/L,所以前20 min内的反应速率v(H2)=0.006mol·L-1·min-1,错误;C、增大c(H2),只能增大CO的转化率,而氢气的转化率降低,错误;D、由所给数据可计算500℃时的化学平衡常数,所以已知CO和H2的物质的量可以计算出反应达平衡后甲醇的浓度,正确,答案选D。
本题难度:一般