1、实验题 (8分)某化工厂排放的污水中含有Al3+、Fe3+、Hg2+、Cu2+四种离子。甲、乙、丙三同学设计从该污水中回收金属铜的方案如下:
甲:污水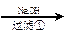
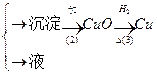 +++++++++++
+++++++++++
乙:污水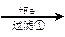
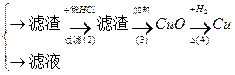
丙:污水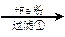
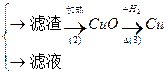
填空和回答:
(1)甲、乙、丙提出的方案能否制得铜?
甲:____________________;乙:____________________;丙:____________________。
(2)在能制得铜的方案中,会导致环境污染的一步操作是:_____________________________
______________________________________________________________________________。
2、选择题 下列叙述中不正确的是( )
A.可以用Si3N4、Al2O3制作高温结构陶瓷制品
B.从“海水提溴”,但得到的液溴中常溶有少量氯气,除去氯气应加入适量的NaBr
C.石油、汽油、聚乙烯、甲苯物质中,汽油有固定沸点
D.用乙醇、溴水、NaOH溶液、盐酸中的溴水来鉴别裂化汽油和直馏汽油
3、填空题 在元素周期表中,铝在硼的正下方,它们有很多相似的化学性质,可以形成许多组成和性质类似的化合物。单质硼可以通过硼镁矿Mg2B2O5·H2O来制取。
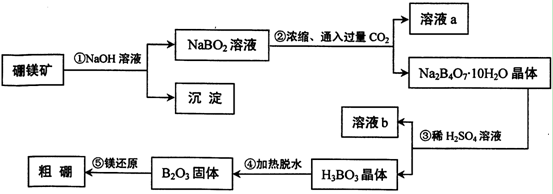
(1)写出步骤①的化学方程式?,
(2)写出步骤②的离子方程式?,
(3)写出表示溶液a物料守恒的关系?;
(4)步骤③中加入稀H2SO4的作用是?;
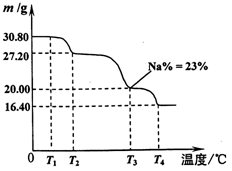
(5)将制得的粗硼在一定条件下反应全部生成BI3,BI3热分解可以得到纯净的单质硼。0.25 g粗硼制成的BI3分解得到的I2全部被收集后,用2.00 mol/L Na2S2O3溶液滴定,达到滴定终点时消耗27.00 mL Na2S2O3溶液。(已知:I2+2S2O32-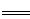 2I-+S4O62-)
2I-+S4O62-)
①滴定过程中所用的指示剂为?,滴定终点的现象是?;
②粗硼中硼的含量为____?;
(6)利用硼砂晶体(Na2B4O7?10H2O)可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。已知纯净的过硼酸钠晶体中各元素的物质的量之比为以n(Na):n(B):n(H):n(O)=1:1:n:7。取过硼酸钠晶体在70℃以上加热将逐步失去结晶水,测得固体质量随温度的变化如图所示,则乃时所得晶体的化学式为?,请写出简要的解题过程。
4、填空题 以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。

已知以下四种物质的溶解度曲线图:
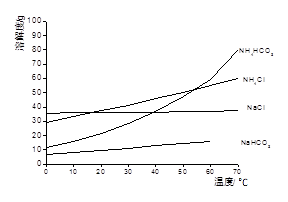
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 ?、?。
(2)“滤渣1”的化学式为?。
(3)在“滤液1”中加入盐酸的目的是?。“滤渣2”的化学式为?。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为?。
物质
| 电离常数(25℃)
|
H2CO3
| K1=4.4X10-7?K2=4.7X10-11
|
H2SO3
| K1=1.23X10-2?K2=5.6X10-8
|
?
5、选择题 下列属于直接利用太阳能的是
①光-热转换②光-电转换③光—化学能转换④光-生物质能转换
A.①②③
B.①③④
C.①②④
D.①②③④