1、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响0~t1时间段反应速率的主要因素是
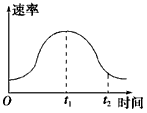
[? ]
A.盐酸的浓度
B.镁条的表面积
C.Cl-的浓度
D.溶液的温度
参考答案:D
本题解析:
本题难度:一般
2、选择题 在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图所示。下列有关说法不正确的是( )
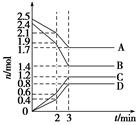
A.该反应的化学方程式为4A+5B
参考答案:
本题解析:
本题难度:一般
3、填空题 Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2
| 触摸试管情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 很烫
| 剧烈反应,带火星的木条复燃
| 3.5min
|
块状
| 微热
| 反应较慢,火星红亮但木条未复燃
| 30min
|
(1)写出上述实验中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析:
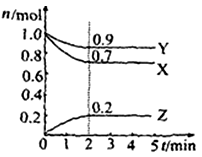
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度 B.加入催化剂 C.增大容器体积
参考答案:Ⅰ(1) 2H2O2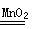 2H2O +O2 ↑ ;2分, 放热;1分(2)催化剂接触面积。1分
2H2O +O2 ↑ ;2分, 放热;1分(2)催化剂接触面积。1分
Ⅱ(1)3X + Y 2Z 2分,(2)0.05 mol·L-1·min-1 2分
2Z 2分,(2)0.05 mol·L-1·min-1 2分
(3)AC 2分,少选得1分,错选不得分
本题解析:Ⅰ(1)H2O2在二氧化锰作用下发生反应的化学反应方程式为2H2O2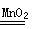 2H2O +O2↑,根据试管很烫可知该反应是放热反应。
2H2O +O2↑,根据试管很烫可知该反应是放热反应。
(2)根据表中给出的数据可知,在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响。
Ⅱ(1)由由图象可以看出,X、Y的物质的量逐渐减小,则X、Y为反应物,Z的物质的量逐渐增多,作为Z为生成物,当反应到达2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=3:1:2,所以反应的化学方程式为:3X + Y 2Z。
2Z。
(2)物质Z浓度的变化量为0.2mol÷2L=0.1mol/L,所以Z物质表示的反应速率为01mol/L÷2min=0.05mol/(L·min)。
(3)A、温度较低反应速率一定是减小的,A正确;B、加入催化剂反应速率可以加快,也可能减小,B不正确;C、增大容器容积,物质的浓度减小,则反应速率减小,C正确,答案选AC。
考点:考查外界条件对反应速率的影响以及可逆反应的有关计算
本题难度:一般
4、选择题 甲、乙两容器内都在进行A→B的反应,甲中每分钟减少4 mol,乙中每分钟减少2 mol,则两容器中的反应速率
A.甲快
B.乙快
C.相等
D.无法判断[
参考答案:D
本题解析:略
本题难度:简单
5、实验题 (10分)下表是稀硫酸与金属镁反应的实验数据:
实验
序号
| 金属质量/g
| 金属
状态
| c(H2SO4)
/mol/L
| V(H2SO4)/mL
| 溶液温度/℃
| 金属消失
的时间/s
|
反应前
| 反应后
|
1
| 0.24
| 丝
| 0.5
| 100
| 20
| 34
| 500
|
2
| 0.24
| 粉末
| 0.5
| 100
| 20
| 35
| 50
|
3
| 0.24
| 丝
| 0.7
| 100
| 20
| 36
| 250
|
4
| 0.24
| 丝
| 0.8
| 100
| 20
| 35
| 200
|
5
| 0.24
| 粉末
| 0.8
| 100
| 20
| 36
| 25
|
6
| 0.24
| 丝
| 1.0
| 100
| 20
| 35
| 125
|
7
| 0.24
| 丝
| 1.0
| 100
| 35
| 50
| 50
|
8
| 0.24
| 丝
| 1.1
| 100
| 20
| 34
| 100
|
9
| 0.24
| 丝
| 1.1
| 100
| 30
| 44
| 40
|
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ____ ,能表明这一规律的分别是实验6和实验 或实验8和实验 ;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验 (填实验序号),该实验中硫酸平均反应速率为 ;
参考答案:(10分)(1)固体反应物的表面积(1分) 表面积越大(1分) 1, 2(1分)
(2)5 (1分) (3)反应温度(1分) 7或9(1分)
(4)5(1分) 0.004mol/(L?s) (2分)
本题解析:考查反应速率的概念、计算及外界条件对反应速率的影响。
(1)根据实验中数据可知,实验4、5中不同的是固体的表面积,所以是探究固体表面积对反应速率影响的。根据实验数据可知,固体表面积越大反应速率越快,能表明同一规律的实验还实验1 和实验2。
(2)要探究反应物浓度对反应速率的影响,则其它条件应该是相同的,所以应该是是实验2和实验5。
(3)本实验中影响反应速率的其他因素还有温度。根据实验数据可知,应该是实验6和实验7或实验8和实验9。
(4)用时最少的实验5,所以反应速率最快。0.24g镁是0.01mol,所以消耗硫酸是0.01mol,起浓度是0.01mol÷0.1L=0.1mol/L,因此起反应速率是0.1mol/L÷25s=0.004mol/(L?s)。
本题难度:一般