1、选择题 下列化学反应,不属于氧化还原反应的是( )
A.2C+O2
2CO
B.2KClO32KCl+3O2↑
C.CaCO3CaO+CO2↑
D.Zn+H2SO4(稀)=ZnSO4+H2↑
参考答案:A.C、O元素的化合价变化,属于氧化还原反应,故A不选;
B.Cl、O元素的化合价变化,属于氧化还原反应,故B不选;
C.没有元素的化合价变化,不属于氧化还原反应,故C选;
D.Zn、H元素的化合价变化,属于氧化还原反应,故D不选;
故选C.
本题解析:
本题难度:一般
2、选择题 只有氧化性的离子是( )
A.Cl-
B.Fe2+
C.MnO4-
D.S2-
参考答案:A.Cl-中Cl元素化合价处于最低价态,只具有还原性,故A错误;
B.Fe2+化合价处于中间价态时,既具有氧化性也具有还原性,故B错误;
C.MnO4-化合价处于最高价态时,只具有氧化性,故C正确;
D.S2-化合价处于最低价态时,只具有还原性,故D错误.
故选C.
本题解析:
本题难度:一般
3、简答题 关于下面氧化还原反应方程式,完成相关问题:KClO3+HCl→Cl2+H2O+KCl
(1)配平该反应方程式,并用双线桥法或单线桥法表示该反应的电子转移方向和数目:
(2)氧化剂______,被氧化元素是______;(填分子式,下同)
(3)HCl的作用是______,还原产物是______.
参考答案:(1)氧化还原反应中,KClO3中氯元素化合价由+5价降低为0价,盐酸中,部分氯元素化合价由-1价升高为0价,氯化钾的生成表现了显酸性的盐酸,根据电子守恒,盐酸的前边系数是6,即KClO3+6HCl═3Cl2+3H2O+KCl,元素化合价升高值等于元素化合价降低值=电子转移数=5,电子转移情况为:
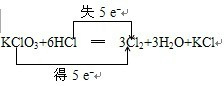
,
故答案为:

;
(2)化合价降低元素Cl所在的反应物氯酸钾是氧化剂,该Cl元素被还原,化合价升高元素Cl所在的反应物盐酸是还原剂,该Cl元素被氧化,故答案为:KClO3;Cl;
(3)盐酸中氯元素化合价一部分升高,显示还原性,一部分不变,生成氯化钾,显示酸性,化合价降低的元素Cl所在的产物?Cl2是还原产物,故答案为:酸性、还原性;Cl2;
本题解析:
本题难度:一般
4、选择题 某学生对反应3Cl2+6KOH=KClO3+5KCl+3H2O的分析和判断中,正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被还原的氯与被氧化的氯的质量比为1:5
C.3molCl2参加反应转移电子5mol
D.KClO3是还原产物,KCl是氧化产物
参考答案:A.反应中只有Cl元素的化合价变化,则Cl2既是氧化剂又是还原剂,故A错误;
B.化合价升高,被氧化,则被还原的氯与被氧化的氯的质量比为5:1,故B错误;
C.由化合价升降可知,3molCl2参加反应,1molCl化合价升高,转移电子为1mol×(5-0)=5mol,故C正确;
D.氧化剂被还原,对应还原产物,还原剂对应氧化产物,则KClO3是氧化产物,KCl是还原产物,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 在标准状况下,0.0672L?H2S气体通入含有1.0×10-3mol?X2O72-离子的酸性溶液中,两者恰好完全反应,而且H2S全部被氧化成硫单质,则X元素在还原产物中的化合价为( )
A.+3
B.+4
C.+2
D.+1
参考答案:在标准状况下,0.0672LH2S的物质的量为0.0672L22.4L/mol=0.003mol,
设X元素在还原产物中的化合价为x,
H2S全部被氧化成硫单质,由氧化还原反应中得失电子守恒可知,
0.003mol×(2-0)=1.0×10-3mol×2×(6-x),
解得x=+3,
故选A.
本题解析:
本题难度:一般