1、填空题 高锰酸钾和盐酸溶液可以发生以下反应:
2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥标出该反应中电子转移的方向和数目.
(2)该反应的氧化产物是______.
(3)若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是______mol.
2、选择题 下列各种物质,在氧化还原反应中通常只可作为氧化剂使用的是( )
A.SO2
B.H2SO4
C.Cl2
D.FeCl2
3、选择题 下列反应中,HNO3只表现出氧化性的是( )
A.H2S+2HNO3═S↓+2NO2↑+2H2O
B.CuO+2HNO3═Cu(NO3)2+H2O
C.4HNO3═4NO2↑+O2↑+2H2O
D.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
4、简答题 2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是______.
A.制备环氧乙烷:2CH2=CH2+O2
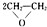
B.制备硫酸铜:Cu+2H2SO4??CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2??2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为______,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是______.
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
乙炔水化法
乙烯氧化法
原料
乙炔、水
乙烯、空气
反应条件
HgSO4、100~125℃
PdCl2-CuCl2、100~125℃
平衡转化率
乙炔平衡转化率90%左右
乙烯平衡转化率80%左右
日产量
2.5吨(某设备条件下)
3.6吨(相同设备条件下)