|
高考化学知识点归纳《反应速率与平衡的有关计算》高频试题强化练习(2019年最新版)(六)
2019-06-25 22:11:52
【 大 中 小】
|
1、选择题
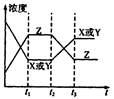

A.增大了X或Y的浓度
B.使用了催化剂
C.增大了体系压强
D.升高了该反应的温度
参考答案:D
本题解析:如果是增大了X或Y的浓度,则在t2时刻X或Y浓度应突然增大,故A不正确,同理可排除C。加催化剂平衡不移动,各组分浓度不变,B也不正确。升高温度平衡逆向移动,使X、Y浓度增大,Z浓度减少,故D正确。
本题难度:一般
2、计算题 (12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)?△H=—97.3kJ/mol SO2Cl2(l)?△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是?(用编号填空)。
A.缩小容器体积
B.使用催化剂
C.增加SO2浓度
D.升高温度
| (2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为?。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为?。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
参考答案:⑴AC? ⑵0.0706? (3分)? (3) 1.25×10-6 (3分)
⑷SO2Cl2+2H2O=H2SO4+2HCl? SO2+Cl2+2H2O=H2SO4+2HCl? H2SO4+BaCl2=BaSO4?↓+2HCl
由S元素质量守恒,可得:BaSO4的物质的量为0.12mol
质量为:0.12mol×233g/mol=27.96g? (4分)
本题解析:(1)缩小容器体积,则气体浓度增大,即压强增大,平衡正向移动,能提高Cl2的平衡转化率;使用催化剂,不影响平衡移动,则不能提高Cl2的平衡转化率;增加SO2浓度,平衡正向移动,能提高Cl2的平衡转化率;升高温度,平衡逆向移动,Cl2的平衡转化率减小;
(2)?SO2(g)+Cl2(g) SO2Cl2(l) SO2Cl2(l)
C(初始)? 0? 0? 0.12
△C? 0.119? 0.119? 0.119
C(平衡) 0.119? 0.119? 0.001
平衡常数K=0.001mol.L-1/(0.119 mol.L-1×0.119 mol.L-1)= 0.0706(mol.L-1)-1;
(3)? AgCl(S) ?Ag+(aq)+Cl-(aq)? ?Ag+(aq)+Cl-(aq)?
Ksp(AgCl)=2.0×10-10=[Ag+][Cl-],则[Cl-]=2.0×10-9 mol.L-1
Ag2SO4(S)  ?2Ag+(aq)+SO42-( aq) ?2Ag+(aq)+SO42-( aq)
Ksp(Ag2SO4)=1.6×10-5=[Ag+]2[SO42-] ,则[SO42-]= 1.6×10-3mol.L-1
故[Cl-]:[SO42-]=1.25×10-6
本题难度:简单
3、填空题 (1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量): 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
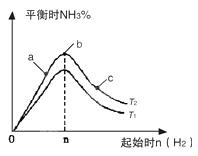 
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
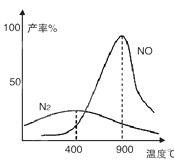
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O ,4NH3+3O2 4NO+6H2O ,4NH3+3O2 2N2+6H2O 2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
参考答案:(14分)(1)①c?②1;K=25/12或2.08,减小③低于?(各2分)
(2)N2,氨气氧化生成NO的反应是放热反应,升高温度转化率下降?(各2分)
本题解析:(1)①三点时温度相同,氢气量越大,氮气的转化率越大,则c点的转化率最高,故答案为:c;
②N2(g)+3H2(g) 2NH3(g) 2NH3(g)
起始 x? 3? 0
转化0.6 ?1.8? 1.2
平衡x-0.6? 1.2? 1.2
N2的转化率为60%,则
0.6mol/x×100%=60%,解得x=1mol,
反应的平衡常数K=(1.2mol·L-1)2/0.4mol·L-1×(1.2mol·L-1)3=2.08(mol·L-1)―2,
由图可知,温度低氨气的含量大,则正反应为放热反应,则升高温度其平衡常数减小,
故答案为:1;2.08(mol·L-1)―2;减小;
③由图可知,其它条件相同时,T1先达到平衡且平衡时氨气的浓度小,则T2低于T1,故答案为:低于;
(2)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,故答案为:N2;氨气氧化生成NO的反应是放热反应,升高温度转化率下降.
本题难度:一般
4、填空题 I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表: 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
时间/s
| 0
| 1
| 2
| ?3
| 4
| 5
| c(NO)/mol·L-1
| 1.00×10-3
| 4.50× 10-4
| 2.50×10-4
| 1.50×10-4
| 1.00×10-4
| 1.00×10-4
| c(CO)/mol·L-1
| 3.60×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH?0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)=?。
(3)该温度下,反应的平衡常数K=?。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。
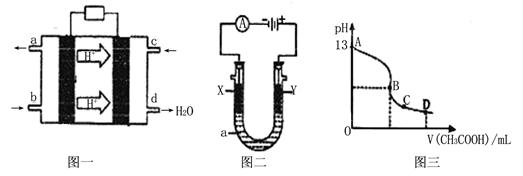
(1)该电池正极的电极反应式为?。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式?。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 )? ?。
参考答案:(共12分,每空2分)
I?(1)<?(2)1.875×10-4 mol·L-1·S-1?或1.9×10-4 mol·L-1·S-1?等等(3)5000
II(1)O2+ 4H+ + 4e- =? 2H2O
(2)2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
(3)c(CH3COO-)> c(K+) > c(H+)> c(OH-)
本题解析:I(1)因该反应2NO+2CO 2CO2+N2中气体减少,则△S<0非自发, 2CO2+N2中气体减少,则△S<0非自发,
由反应能够自发进行,则△H-T△S<0,即该反应一定是放热才有可能自发进行,
放热反应的△H<0,故答案为:<;
(2)由化学反应速率之比等于化学计量数之比,则
υ(N2)=1/2υ(NO)≈1.88×10-4mol?L-1?s-1,故答案为:1.88×10-4mol?L-1?s-1;
(3)由表格中的数据可知到4s时达到化学平衡,则
2NO+2CO 2CO2+N2 2CO2+N2
开始1.00×10-33.60×10-3 0 0
转化9×10-49×10-49×10-4 4.50×10-4
平衡1.00×10-4 2.70×10-3 9×10-44.50×10-4
则K=[(9×10-4)2?(4.5×10-4)]/[ (1×10-4)2?(2.7×10-3)2] =5000,故答案为:5000;
II、(1)正极充入的是O2,得到电子,电极式为O2+ 4H+ + 4e- =? 2H2O。
(2)电解KCl溶液的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。 Cl2↑+H2↑+2OH-。
(3) ““(2)”电解一段时间后的溶液为碱性,滴入醋酸溶液后酸性增强,C点的各离子浓度的大小关系为c(CH3COO-)> c(K+) > c(H+)> c(OH-)。
点评:本题综合考查反应速率、反应方向、化学平衡、电解原理等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,是较好的一道综合题。
本题难度:一般
5、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)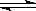 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)? CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)?

A.反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B.升高温度,K值增大
C.在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB /2nB mol·(L·min)-1
D.其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
参考答案:A
本题解析:略
本题难度:简单
| 