1、填空题 (14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。

将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。
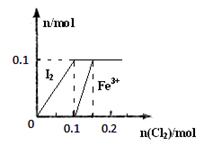
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
2、填空题 (10分)K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成正三价铬时,颜色变为绿色。据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的检验装置吹气。若发现硅胶变色达到一定程度,即可证明司机是酒后驾车。这时酒精被氧化为醋酸其反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式: 。
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由 色变为 色。
(3)上述反应中氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。(本题中的四个空都需填写物质的化学式)
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是
3、简答题 锌、碳酸钙、氧气、盐酸、硫酸铜溶液五种物质中选出1种或2种为反应物,按下列反应类型各写1个化学方程式:
(1)化合反应______;
(2)分解反应______;
(3)置换反应______;
(4)复分解反应______.
4、简答题 向38.4g铜片中加入某浓度的硝酸150mL,在加热条件下反应,待铜片全部溶解后,收集到气体22.4L(标准状况下),求:
(1)NO、NO2的体积各为多少?
(2)待反应产生的气体完全释放后,向溶液中加入V?ml?a?mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度是多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少克?
5、选择题 下列化学用语正确的是
A.H2S的电子式:
B.钙原子结构示意图: 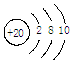
C.Na2O2的电子式: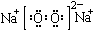
D.铁离子:Fe2+