1、填空题 (14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。

将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。
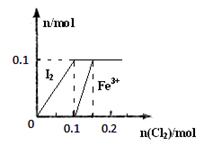
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
参考答案:(14分,每空2分)
(1)C Cl2、HClO、ClO-
(2)H++ClO-=HClO 2H++ClO-+Cl-=Cl2↑+ H2O
(3)① Fe2+ 0.06mol Fe3+ 0.04mol ② 8.96L
本题解析:(1)氯气比空气重,需采用向上排空气法收集,氯气有毒,不能排放到空气中,需进行尾气吸收,A集气瓶密封,无法进入气体,错误,B无尾气吸收装置,错误;D气体直接进入NaOH溶液中,发生反应收集不到氯气,错误;选C,氯气通入水中,发生反应Cl2+H2O HCl+HClO,氯水中有Cl2、H2O、H+、Cl-、ClO-、HClO六种微粒,所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
HCl+HClO,氯水中有Cl2、H2O、H+、Cl-、ClO-、HClO六种微粒,所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
(2)工业制备漂白粉的化学反应为2Cl2+2Ca(OH)2 =CaCl2 +Ca(ClO)2+2H2O,漂白粉的成分为CaCl2、Ca(ClO)2,漂白粉与稀盐酸发生复分解反应,离子方程式为H++ClO-=HClO。漂白粉与浓盐酸发生氧化还原反应,离子方程式为2H++ClO-+Cl-=Cl2↑+ H2O。
(3)①根据图可知氯气在通入0.1mol之后开始和Fe2+反应,在0.15mol时反应完全,所以反应掉Cl2 0.05mol Cl2 + 2Fe2+=2Cl-+2Fe3+ Cl2 + 2Fe2+=2Cl-+2Fe3+
0.05 0.1 0.02 0.04 0.04
溶液中所含金属阳离子为Fe2+ :0.1-0.04="0.06mol" , Fe3+ :0.04mol
②根据图和①可知,FeI2的物质的量为0.1mol,则Fe2+:0.1mol, I-:0.2mol,
Cl2+ 2Fe2+=2Cl-+2Fe3+ Cl2 + 2I-=2Cl- + I2
0.05 0.1 0.1 0.1 0.2 0.2 0.1
所以在发生第三个反应之前溶液中Cl-为0.3mol,设第三个反应生成Cl-的物质的量为x mol,根据5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
0.5x x 0.2x (0.3+x)÷(0.2x)="8÷1," 解得x=0.5mol,
通入的Cl2在标准状况下的体积为(0.05+0.1+0.25)×22.4=8.96L。
考点:考查氯气的收集,氯水的成分,漂白粉的化学性质,氯气的性质等知识。
本题难度:困难
2、填空题 (10分)K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成正三价铬时,颜色变为绿色。据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的检验装置吹气。若发现硅胶变色达到一定程度,即可证明司机是酒后驾车。这时酒精被氧化为醋酸其反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式: 。
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由 色变为 色。
(3)上述反应中氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。(本题中的四个空都需填写物质的化学式)
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是
参考答案:(1)2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O
(2)橙红色;绿色
(3)K2Cr2O7,CH3CH2OH,CH3COOH,Cr2(SO4)3
(4)1mol
本题解析:(1)2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O的离子方程式为:
2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O
(2)司机属于醉酒驾车,发生反应2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,还原生成正三价铬离子,颜色变为绿色,则观察到检验装置中的硅胶将由红色变为绿色。
(3)把H、O的价态分别定为+1、-2(即它们的价态不变),碳元素价态可变:其价态根据化合物中化合价的代数和为零进行推算,据此有:CH3CH2OH中C的平均价态为-2价,而在产物乙酸中C的,平均价态为0价,显然CH3CH2OH是还原剂,CH3COOH是氧化产物。由于K2Cr2O7中的Cr为+6价,而在产物Cr2(SO4)3中Cr的化合价为+3价,故K2Cr2O7是氧化剂,Cr2(SO4)是还原产物
(4)结合反应可知)2K2Cr2O7-3CH3CH2OH当有69g酒精发生反应时消耗K2Cr2O7的物质的量是1mol
考点:氧化还原反应
本题难度:一般
3、简答题 锌、碳酸钙、氧气、盐酸、硫酸铜溶液五种物质中选出1种或2种为反应物,按下列反应类型各写1个化学方程式:
(1)化合反应______;
(2)分解反应______;
(3)置换反应______;
(4)复分解反应______.
参考答案:(1)化合反应是由两种或两种以上的物质生成另一种物质的化学反应,故答案为:2Zn+02△.2ZnO;
(2)分解反应是由一种物质生成两种或两种以上其他物质的化学反应,故答案为:CaCO3高温.CaO+CO2↑;
(3)置换反应是一种单质和一种化合物反应,生成另外一种单质和化合物的反应,故答案为:Zn+CuSO4=ZnSO4+Cu;
(4)复分解反应是两种化合物相互反应生成另外两种新的化合物,故答案为:2HCl+CaCO3=CaCl2+H2O+CO2↑.
本题解析:
本题难度:一般
4、简答题 向38.4g铜片中加入某浓度的硝酸150mL,在加热条件下反应,待铜片全部溶解后,收集到气体22.4L(标准状况下),求:
(1)NO、NO2的体积各为多少?
(2)待反应产生的气体完全释放后,向溶液中加入V?ml?a?mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度是多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少克?
参考答案:n(Cu)=38.4g64g/mol=0.6mol,n(气体)=22.4L22.4L/mol=1mol,
(1)令混合气体中NO和NO2物质的量分别为xmol、ymol,则
本题解析:
本题难度:一般
5、选择题 下列化学用语正确的是
A.H2S的电子式:
B.钙原子结构示意图: 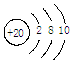
C.Na2O2的电子式: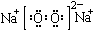
D.铁离子:Fe2+
参考答案:C
本题解析:A选项硫化氢属于共价化合物,所以A选项书写错误。B选项,最外层电子数不能超过8,所以B选项是错误的。D选项铁离子为三价,二价为亚铁离子,所以D选项是错误的。故答案选C
本题难度:一般