1、填空题 溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 ??条件下进行,目的是为了避免?。
(2)Br2可用热空气吹出,其原因是?。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 ??。步骤②的产品有时运输到目的地后再酸化,主要是因为 ?.
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中?。?
a.通入HBr? b.加入Na2CO3溶液? c.加入NaBr溶液? d.加入Na2SO3溶液
参考答案:
(1)酸性,Cl2歧化。
(2) Br2易挥发。
(3)3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.溴酸能将Cl-氧化成Cl2,原因是Br2有强氧化性。
(4)ac。
本题解析:Cl2与水发生歧化反应:Cl2+H2O=HCl+HClO,在酸性条件下可抑制该反应。步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应;因为Br2有强氧化性,为了防止在运输过程中Br2与其它物质反应,因此步骤②的产品有时运输到目的地后再酸化。利用Br-与Cl2反应,可除去Cl2。
【考点定位】本题考查工业制Br2,考查分析问题解决问题的能力。
本题难度:一般
2、填空题 某有机物A是一种重要中间体.
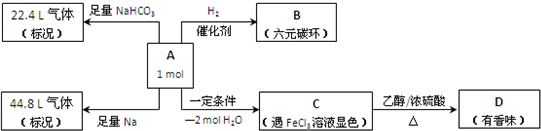
(1)已知有机物A的相对分子质量不超过180,若将A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,反应中消耗的O2和生成的CO2的物质的量相等,有机物A的分子式为______.
(2)根据有机物A能与NaHCO3反应放出气体,可知A分子中含有的官能团的名称是______.
(3)有机物A分子中有四个相邻的取代基,且碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在,又知C分子的碳环上的一氯取代物只有两种结构.则B的结构简式为______.
(4)写出下列反应的化学方程式.
①A+NaHCO3(足量):______.
②CD:______.
(5)C的同分异构体中,含有三个取代基的异构体共有______种,请写出其中一种的结构简式______.
参考答案:(1)A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,所以C和H的个数之比是:7:10,又因为A分子的相对分子质量不超过180,并且消耗的O2和生成的CO2的物质的量相等,即1molA消耗氧气7mol,可以确定分子式为C7H10O5,故答案为:C7H10O5;
(2)能与NaHCO3反应放出气体的是羧酸类物质,所以A分子中含有的官能团是羧基,故答案为:羧基;
(3)有机物A分子中有四个相邻的取代基,发生消去反应失去2个水分子后的C的碳环上的一氯取代物只有两种结构,所以A为
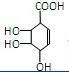
,C为:
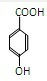
,所以B为:

,故答案为:

;
(4)A

中含有羧基,可以和NaHCO3(足量)反应,实质是:
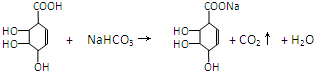
,C

中含有羧基,可以和醇发生酯化反应,即
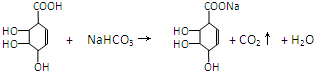
,故答案为:
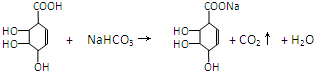
;
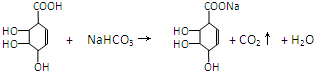
;
(5)

中的羧基和羟基醛化为同分异构体,可以将羧基化为醛基和羟基,含有三个取代基的异构体共有
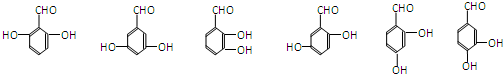
六种,故答案为:6;

.
本题解析:
本题难度:一般
3、选择题 化学用语是国际通用的化学语言,下列有关说法正确的是(?)
A.2O表示两个氧分子
B.银离子的符号为Ag+
C.一氧化碳的化学式是Co
D.H2O中含有氢分子
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (10分)越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟。一些“毒奶粉”竟然顶着国家“免检产品”桂冠。某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7. 8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味,能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是______,若有1.75 mol的还原剂被氧化,则被还原的氧化剂是_______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒。进行实验时,必须选用的物质有________。(填编号)
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂__________能使NaNO2转化为不引起二次污染的N2。(填编号)
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为____________________________________________。
参考答案:(1)NaNO2 1.75 (2)②⑤ (3)② NaNO2+NH4Cl=N2↑+NaCl+2H2O
本题解析:(1)在反应2NaNO2+4HI=2NO+I2+2NaI+2H2O中NaNO2中的N元素的化合价降低,获得电子,所以NaNO2是氧化剂;HI中的I元素的化合价升高,失去电子,被氧化,作还原剂;若有1.75 mol的还原剂被氧化,失去电子1.75 mol,根据氧化还原反应中电子转移数目相同可知:被还原的氧化剂是1.75mol;(2)若某物质是NaNO2,用碘化钾淀粉试纸和食醋在酸性下发生氧化还原反应产生碘单质遇淀粉变为蓝色;若是NaCl,就不会发生上述现象,因此选项物质是②⑤;(3) NaNO2有强氧化性,利用含有N元素的低价态的化合物NH4Cl发生归中反应就会转化为无污染的N2。选项是②,反应的方程式是NaNO2+NH4Cl=N2↑+NaCl+2H2O。
考点:考查氧化还原反应的概念、计算、物质的检验及化学方程式的书写的知识。
本题难度:一般
5、选择题 下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是(?)
A.浓硫酸的质量增加
B.铝的表面生成致密的氧化物薄膜
C.澄清的石灰水变浑浊
D.氢氧化钠固体发生潮解
参考答案:B
本题解析:A、浓硫酸具有吸水性,久置于空气中增重,属于物理变化,错误;B、铝的表面生成致密的氧化物薄膜是由于铝被空气中氧气氧化为氧化铝的原因,发生氧化还原反应,正确;C、澄清的石灰水与空气中二氧化碳反应生成碳酸钙而变浑浊,发生复分解反应,错误;D、氢氧化钠固体发生潮解,潮解为物理变化,不发生化学变化,错误。
本题难度:一般