1、实验题 某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验
| 实验过程
| 实现现象
|
①
| 通入一段时间N2,加热
| A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体
|
②
| 用带有火星的木条靠近装置D的导管口
| 木条复燃
|
③
| 充分反应,停止加热,冷却后,取A中固体,加盐酸
| 固体溶解,溶液呈黄色
|
④
| 将③所得溶液滴入D试管中
| 溶液变为浅绿色
|
?
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
参考答案:(1)Fe2O3+6H+=2Fe3++3H2O
(2)SO2 有Fe2O3生成,在FeSO4中只有+6价S有氧化性(能被还原),因此一定有SO2生成
(3)2Fe3++SO2+2H2O=2Fe2++SO42—+4H+
(4)不正确,因为分解反应有O2和SO2生成,水溶液中发生反应:2SO2+O2+2H2O=2H2SO4,故无论分解反应是否有SO3生成,都会有此现象
本题解析:加热FeSO4固体,根据实验现象及氧化还原反应知识,FeSO4分解生成Fe2O3和O2外,还有SO2生成。因为FeSO4分解生成的O2和SO2在水溶液中发生反应生成H2SO4,故无论FeSO4分解时是否有SO3产生,B中都有白色沉淀;若有SO3产生,C中的浓硫酸可吸收SO3。O2和SO2进入D中,在冰盐水混合物作用下,SO2变为无色液体,将FeCl3溶液滴入D试管中,发生反应:2Fe3++SO2+2H2O=2Fe2++SO42—+4H+。
本题难度:一般
2、选择题 高炉炼铁中石灰石的作用
A.除S、P 等杂质
B.催化剂
C.除二氧化硅
D.脱氧
参考答案:C
本题解析:高炉炼铁中石灰石的作用是除二氧化硅,答案选C
本题难度:简单
3、填空题 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
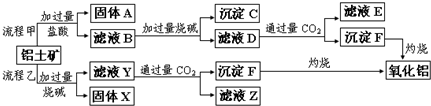
请回答下列问题:
(1)Fe的原子序数为26,Fe位于元素周期表中第______周期,第______族.
(2)流程甲加入盐酸后生成Al3+的离子方程式为______;流程乙加入烧碱后生成SiO32-的离子方程式为______.
(3)滤液E中溶质的主要成份是______(填化学式),写出该溶液的一种用途:______.
(4)写出检验滤液B中是否含Fe3+离子的方法:______.
参考答案:(1)26-2(第1周期元素种类)-8(第2周期元素种类)-8(第3周期元素种类)=8<18(第4周期元素种类),所以Fe位于元素周期表中第四周期,第 VIII族,
故答案为:四;VIII;
(2)Al2O3与盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+═2Al3++3H2O;
SiO2与氢氧化钠反应生成硅酸钠和水,离子方程式为SiO2+2OH-═SiO32-+H2O.
故答案为:Al2O3+6H+═2Al3++3H2O;SiO2+2OH-═SiO32-+H2O;
(3)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3;制纯碱或做发酵粉等;
(4)Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+.
本题解析:
本题难度:一般
4、实验题 已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案:
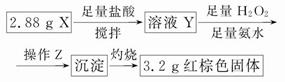
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
参考答案:(1)Fe3O4也能被磁铁吸附,故不能由此确定X就是铁单质
(2)①检验是否存在Fe3+,确认Fe3O4的存在
②Fe+2Fe3+=3Fe2+
(3)①过滤、洗涤
②n(Fe3O4)=0.01 mol;n(Fe)=0.01 mol
本题解析:①通过操作Z得到沉淀,所以该操作是过滤、洗涤;②由题意,n(Fe)×56+n(Fe3O4)×232=2.88,[n(Fe)+3n(Fe3O4)]×160/2=3.2。解得:n(Fe)=0.01 mol,n(Fe3O4)=0.01 mol
本题难度:一般
5、计算题 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为?L,NO2的体积为??L。
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为??mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水?
?g。
参考答案:(1)5.8? 5.4?(2) (av.10-3+0.5)/0.14?(3)57.67
本题解析:铜与一定浓度的硝酸反应所涉及的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+NO2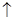 ;3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO
;3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO
(1)设NO的体积为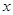 L,则NO2的体积为
L,则NO2的体积为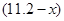 L,由上述方程式可知①与稀硝酸反应的铜的质量为
L,由上述方程式可知①与稀硝酸反应的铜的质量为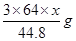 ;②与浓硝酸反应的铜的质量为
;②与浓硝酸反应的铜的质量为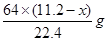 。因此可得如下等式:
。因此可得如下等式: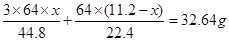 ,解得
,解得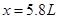 。因此NO的体积为5.8L;NO2的体积为5.4L。
。因此NO的体积为5.8L;NO2的体积为5.4L。
(2)溶液中铜离子的物质的量 ,因此原硝酸的物质的量浓度
,因此原硝酸的物质的量浓度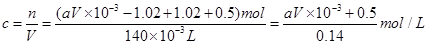
(3)发生的反应为2NO2+H2O2=2HNO3、2NO+3H2O2=2HNO3+2H2O。设与NO2反应的H2O2的质量为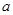 ,与NO反应的H2O2的质量为
,与NO反应的H2O2的质量为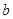 ,则可得如下关系式:
,则可得如下关系式: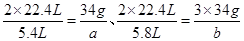 ,解得
,解得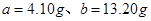 ,因此需要30%的双氧水的质量为
,因此需要30%的双氧水的质量为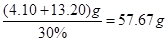 。
。
点评:本题考查了铜与硝酸反应中所涉及到的计算,属于基础题。解题的关键在于正确写出化学方程式,在计算的过程中应注意关系式法、守恒法的应用。
本题难度:一般