1、实验题 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
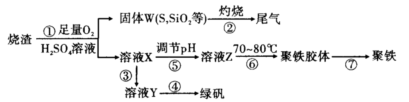
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为?。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的?吸收。
a.浓H2SO4? b.蒸馏水? c.NaOH溶液? d.浓硝酸
(3)过程③中,需要加入的物质名称是?
(4)过程④的实验操作是?
(5)过程⑥中,将溶液Z加热到70~80℃,目的是?。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为?。
参考答案:
(1)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S(2分)
(2)c(2分)?(3)铁(2分)
(4)蒸发(浓缩)、(冷却)结晶、过滤、洗涤(4分,浓缩、冷却不写可以不扣分)
(5)促进Fe3+的水解(2分)
(6)31.11%(3分)
本题解析:
(1)根据固体W的成分中存在S,推出FeS和O2、H2SO4发生氧化还原反应,FeS做还原剂,O2作氧化剂,产物有Fe2(SO4)3、S、H2O。
(2)污染物是SO2,用碱液吸收。
(3)溶液X中的铁是Fe3+,绿矾中的铁为Fe2+,故应加入Fe粉,将Fe3+还原为Fe2+。
(4)对能形成结晶水合物的盐溶液不能采取直接蒸干的办法制取晶体。
(5)升高温度,促进Fe3+的水解。 (6)③得到的沉淀是BaSO4,n(BaSO4) =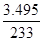 =0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
=0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
本题难度:一般
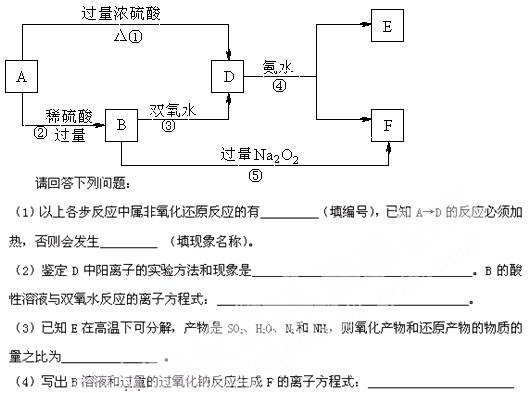
2、填空题 (13分)A是一种常见金属,各物质的转化关系如下图(反 应中其它产物未列出):
应中其它产物未列出):
参考答案:

本题解析:略
本题难度:困难
3、填空题 (11分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
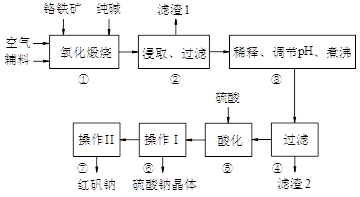
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2  ?8Na2CrO4 + 2Fe2O3 + 8CO2
?8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应有多个如:Al2O3 + Na2CO3 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。请再写一个①中的副反应方程式?
(2)“②”中滤渣1的成分是____ 和____,“③”中调pH值是_______ (填“调高”或“调低”),“④”中?滤渣2的成分是H2SiO3、Al(OH)3 。
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:__________________________。
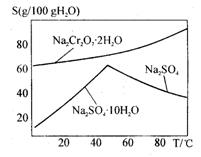
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II 是______(填序号)。
是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
参考答案:

本题解析:略
本题难度:一般
4、填空题 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = ?N a2Fe2O4+?NH3+?NaOH
a2Fe2O4+?NH3+?NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  ?Fe3O4+4NaOH
?Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为?,被还原物质是? 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:?。
参考答案:

本题解析:略
本题难度:一般
5、计算题 用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1)?写出上述各个分步反应(1,2,3,4)的化学方程式。
2)?给出总反应方程式的系数。
3)?据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4)?最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
沸腾炉温度/℃
| 560
| 580
| 600
| 620
| 640
| 660
|
生
成
物
| 水溶性Cu/%
| 90.12
| 91.24
| 93.50
| 92.38
| 89.96
| 84.23
|
酸溶性Cu/%
| 92.00
| 93.60
| 97.08
| 97.82
| 98.16
| 98.19
|
酸溶性Fe/%
| 8.56
| 6.72
| 3.46
| 2.78
| 2.37
| 2.28
|
回答如下问题:
(1) ?CuFeS2和O2主要反应的方程式为:
(2) ?实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) ?温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
参考答案:(1)2CuFeS2 + O2 =Cu2S + 2FeS +SO2?(1分)
(写S、SO3不写SO2不得分)
FeS + O2 =" FeO" + SO2?(1分)
(写S、SO3不写SO2不得分)
FeO + SiO2 = FeSiO3?(1分)?
(写其他产物不得分)
2Cu2S + 3O2 = 2Cu2O+ 2SO2? (1分)
(写S、SO3不写SO2不得分)
Cu2S+ 2Cu2O =" 6Cu" + SO2 ?(1分)
(写S、SO3不写SO2不得分)
不配平不得分。
(2)2CuFeS2 + 2SiO2 + 5O2 =" 2Cu" + 2FeSiO3 + 4SO2
(3)4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O? (4分)
(注:不写硫酸铁而写硫酸亚铁给一半分)
(4)(1) 4CuFeS2 + 17O2 = 4CuSO4 + 2Fe2O3 + 8SO2? (4分)
(2) ?控制加入CuFeS2的速度,因CuFeS2与O2反应放热。? (2分)
(3) ?CuSO4 =" CuO" + SO3?(2分) ?
?(答SO2 + 1/2O2不扣分)
(注:(1)的反应产物不写氧化铁写氧化亚铁或四氧化三铁也可以给一半分。
虽然实际反应产物是氧化铁, 但对中学生, 做出正确判断根据可能不足。)
本题解析:本题由三个相互独立的问题组成,可以认为是三个题,占总分的较大比例,但由于都是有关黄铜矿的利用问题,因而被编在一起,而且多少相互之间可以起到“条件不同反应不同”的关联作用。与前两题相比,本题的第一部分比较简单,好像是命题人考虑着对前面的试题可能解答得不好的学生起一点安抚鼓励作用。写四个分步反应的方程式的考核点只是把题面的表述转换成化学方程式,但题面并没有指出生成物中的硫的形态。根据中学化学知识,可以想见它是SO2,大多数学生应该不会写错。其中第四个反应就是所谓“冰铜”反应,比较特殊,但试题已经告诉大家反应产物的含铜物质应该只有一种,即金属铜,这就降低了难度,可见应答时永远不应离开试题提供的知识背景。
问题(2)配平总方程式的系数,比较费事,考查机敏。配平的方法很多,条条大路通罗马。比较简单的是不管黄铁矿里的铜、铁和硫应当是什么价态的,假设铁是+2价的,铜也是+2价的,硫是-2价的,这样,铁在反应后价态不变,就省事多了。这种假设不会出现错误,其原因是氧化还原的电子得失总数是一定的。
问题(3)也是写方程式,熟悉过去竞赛试题的选手可能觉得似曾相识,但并非陈题。根据给出的信息,不难首先得出这样的结论:反应得到的溶液由CuSO4和Fe3(SO4)2组成。因为有氧气参加反应,铜和铁均应成水溶液中的稳定高价,似不会弄错。考虑到学生可能的错误,判分标准比较松。这个反应的关键是产物里要添硫酸根,为此题面对反应的条件作了说明:酸性溶液;但为避免暗示过多,没有说要加硫酸。
分析应答结果,许多学生因不会正确书写离子方程式和分子方程式二而失分。他们写的方程式是“非驴非马”的既非离子方程式又非分子方程式的“混杂”方程式。这中错误是严重的,不利于今后的学习,不能给分。我们建议正常课堂教学要针对学生这种错误来训练。
问题(4)比前面的试题更推进一步,信息是以表格中的数据的形式间接地呈现的。表格用沸腾炉的温度首先排除学生对“沸腾”二字的可能误解,这里的“沸腾”并非意味着炉子里有水之类的溶剂(试题设计人估计学生并没有固体在上行气流冲击下如同沸腾的那种工业反应器的概念,并没有考察这样专门的知识,但中学老师说,沸腾炉的概念在讲黄铁矿制硫酸中讲到的)。表格还用水溶性铜、酸溶性铜和酸溶性铁的信息表明,沸腾炉里的含铁产物肯定不是铁的硫酸盐,因为并没有说有水溶性铁,因而可以得出结论:燃烧产物中的铁是以氧化物的方式存在的。(这正是与本题一开始的传统冶炼反应不同之处,否则为什么是最新成果,而且是我国学者的成果呢?)至于铁的氧化物为什么随温度升高溶于酸的程度降低?本题没有要求作答。这个知识大大超过中学生的知识水平。其实,氧化物的酸溶性随煅烧或烧结温度升高而下降是一个普遍现象。例如用作炼钢炉衬里的氧化镁就是经过高温烧结的酸溶性很差的氧化物,还可以举出的典型物质是刚玉(Al2O3),用作坩埚等高温容器,酸溶性极差。这些化学知识似应在优秀中学生中间做点普及,不要以为碱性或两性金属氧化物都易溶于酸(热力学上要溶,动力学上不溶!)。本题给分充分考虑了中学生的知识水平,比较宽松。
本题难度:一般