1、实验题 某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验
| 实验过程
| 实现现象
|
①
| 通入一段时间N2,加热
| A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体
|
②
| 用带有火星的木条靠近装置D的导管口
| 木条复燃
|
③
| 充分反应,停止加热,冷却后,取A中固体,加盐酸
| 固体溶解,溶液呈黄色
|
④
| 将③所得溶液滴入D试管中
| 溶液变为浅绿色
|
?
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
2、选择题 高炉炼铁中石灰石的作用
A.除S、P 等杂质
B.催化剂
C.除二氧化硅
D.脱氧
3、填空题 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
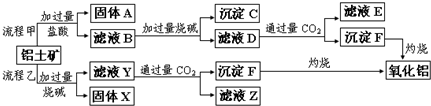
请回答下列问题:
(1)Fe的原子序数为26,Fe位于元素周期表中第______周期,第______族.
(2)流程甲加入盐酸后生成Al3+的离子方程式为______;流程乙加入烧碱后生成SiO32-的离子方程式为______.
(3)滤液E中溶质的主要成份是______(填化学式),写出该溶液的一种用途:______.
(4)写出检验滤液B中是否含Fe3+离子的方法:______.
4、实验题 已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案:
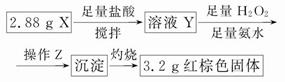
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
5、计算题 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为?L,NO2的体积为??L。
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为??mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水?
?g。