|
|
|
高考化学知识点归纳《铁的氧化物》试题预测(2019年最新版)(五)
2019-06-25 22:20:12
【 大 中 小】
|
1、选择题 下列说法正确的是(? )
A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+
B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol
C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂
D.生铁与浓H2SO4加热反应可产生SO2和CO2气体
2、选择题 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是? ( )。

A.①②③④⑤
B.①②③⑤
C.①②③④
D.②③④⑤
3、实验题 (14分)Fe在地壳中的含量虽次于铝,但铁及其化合物在生活、生产中的应用最广泛。请回答下列问题:
(1)Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备铁酸钠的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
| (2)硫酸亚铁晶体(FeSO4·7H2O),俗称“绿矾”,常作医药上的补血剂。课外研究性小组测定某片状补血药品中铁元素的含量。实验步骤如下:
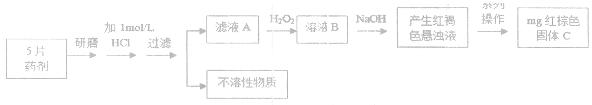
请回答下列问题:
①该小组发现将片状补血剂长 时间置于空气中,表面“发黄”,请用化学方程式表示原因?。 时间置于空气中,表面“发黄”,请用化学方程式表示原因?。
②课外研究性小组发现在滤液A中滴入少量KClO溶液,并加入适量硫酸,溶液立即变黄。
甲同学推测该反应的还原产物有两种可能:①Cl2、②Cl-
乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是(填序号)?;用离子方程式说明理由?。
③若该实验温度下,上述红褐色难溶物质的溶度积为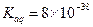 试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3) 试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
④若实验过程中无损耗,最后称量得到mg红棕色的固体,则每片补血剂中含铁元素的质量为?g(用含m的式子表示)
⑤丙同学认为蒸干灼烧溶液B,也可以制得红棕色固体C,请结合化学方程式加以说明
?。
4、实验题 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。
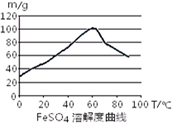
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
A.浓硫酸
B.10moL/L硫酸
C.3moL/L硫酸
D.任意浓度硫酸;
|
温度宜控制在______;加热的同时需适当补充水,原因是
?。反应中应保持n(Fe)/n(H2SO4)
?1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是
? 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
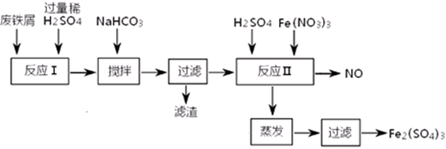
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
5、实验题 某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是?。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
序号
| 实验内容
| 实验现象
| 离子方程式
| 实验结论
|
①
| 在FeCl2溶液中滴入适量氯水
| 溶液由浅绿色变为棕黄色
| ?
| Fe2+具有还原性
|
②
| 在FeCl2溶液中加入锌片
| 
| Zn+Fe2+=Zn2++Fe
| ?
|
③
| 在FeCl3溶液中加入足量铁粉
| ?
| Fe+2Fe3+=3 Fe2+
| Fe3+具有氧化性
|
④
| ?
| 
| ?
| Fe3+具有氧化性
|
实验结论:
?。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:
?。(填序号)
A.Cl2
B.Na
C.Na+
D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化
?。

 时间置于空气中,表面“发黄”,请用化学方程式表示原因?。
时间置于空气中,表面“发黄”,请用化学方程式表示原因?。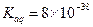 试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)

