| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《铁的氧化物》试题预测(2019年最新版)(六)
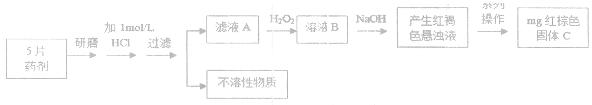 请回答下列问题: ①该小组发现将片状补血剂长  时间置于空气中,表面“发黄”,请用化学方程式表示原因?。 时间置于空气中,表面“发黄”,请用化学方程式表示原因?。②课外研究性小组发现在滤液A中滴入少量KClO溶液,并加入适量硫酸,溶液立即变黄。 甲同学推测该反应的还原产物有两种可能:①Cl2、②Cl- 乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是(填序号)?;用离子方程式说明理由?。 ③若该实验温度下,上述红褐色难溶物质的溶度积为 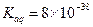 试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3) 试计算该物质沉淀完全所需要的pH=?(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)④若实验过程中无损耗,最后称量得到mg红棕色的固体,则每片补血剂中含铁元素的质量为?g(用含m的式子表示) ⑤丙同学认为蒸干灼烧溶液B,也可以制得红棕色固体C,请结合化学方程式加以说明 ?。 参考答案: 本题解析:略 本题难度:一般 4、实验题 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用. |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
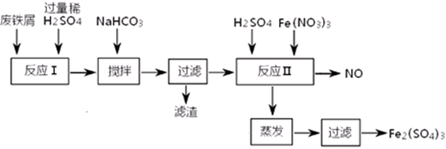
参考答案:
(1)倾析?
(2)C ; 60℃左右;防止硫酸亚铁晶体析出;> ?
(3)抑制Fe2+、NH4+的水解
(4)4.4~7.5 ?
(5)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)节约Fe(NO3)3、防止NO污染(同理即可); 3:4
本题解析:
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法。
(2)在室温下,Fe在浓硫酸中会发生钝化现象。在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水。不能得到硫酸亚铁。所以要用3moL/L硫酸。选项为C。由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右。为防止硫酸亚铁晶体析出,加热的同时需适当补充水。为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些。所以反应中应保持n(Fe)/n(H2SO4)>1。
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
(4)含有少量Al的废铁屑硫酸溶解得到硫酸铝、硫酸亚铁、硫酸铁。为了除去杂质Al3+、Fe2+.要加NaHCO3时,来调节混合液pH值。Al(OH)3沉淀完全的pH为4.4,而Fe(OH)2开始形成沉淀的pH为应控制在7.5。若把混合液pH值控制在4.4~7.5,就可以使Al(OH)3沉淀完全但Fe元素都留在溶液中。
(5)当向含有FeSO4、Fe2(SO4)3溶液中加入Fe(NO3)3和H2SO4时也就相当于加入了稀硝酸。发生氧化还原反应。在反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
(6)由于在室温下会发生反应:2NO+O2=2NO2;3NO2+H2O =2HNO3+NO。叠加得到总方程式为4NO+3O2+2H2O =4HNO3。所以实际生产中,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染。根据上述总方程式可以看出气体O2与NO配比的比例是3:4。
本题难度:困难
5、实验题 某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是?。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ? | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 |  | Zn+Fe2+=Zn2++Fe | ? |
| ③ | 在FeCl3溶液中加入足量铁粉 | ? | Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
| ④ | ? |  | ? | Fe3+具有氧化性 |
参考答案:(18分)
(1)试管?
(2)①Cl2+2Fe2+=2Cl-+2Fe3+?②Fe2+有氧化性?③铁粉逐渐溶解,溶液由棕黄色变为浅绿色?④在FeCl3溶液中加入铜片? Cu+2Fe3+= Cu2++2Fe2+?实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)A E F
(4)在亚铁盐溶液中加入少量稀硫酸和铁粉
(以上每空2分)
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《离子反应》.. | |