|
高中化学知识点大全《铁的氧化物》考点强化练习(2019年押题版)(八)
2019-06-25 22:34:22
【 大 中 小】
|
1、选择题 往FeCl3溶液中滴入KSCN溶液反应,其产物的颜色是
A.血红色
B.红褐色
C.淡黄色
D.蓝色
参考答案:A
本题解析:FeCl3与KSCN发生络合反应,生成血红色的物质;
本题难度:简单
2、填空题 以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:

回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
A.Cu;
B.Cu2(OH)2CO3;
C.H2SO4;
D.Fe;E.CuO
| (2)滤渣A的主要成分为 ?(写化学式)。
(3)写出反应Ⅰ的化学方程式: ?。
(4)试剂a为 ? 。
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 (写操作名称)。
(6)生产过程中,除了试剂a、H2O可以循环使用外,还可循环使用的物质有 (写化学式)。
参考答案:(1)BE
(2)Fe(OH)3
(3)2CuSO4+2H2O 2Cu+2H2SO4+O2↑ 2Cu+2H2SO4+O2↑
(4)铁粉
(5)蒸发浓缩、冷却结晶、过滤
(6)H2SO4、O2
本题解析:(1)流程图中的混合溶液为CuSO4和Fe2(SO4)3。调节pH的目的是除去Fe3+,Fe3+水解的方程式为:Fe3++3H2O Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环 Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环
使用。
本题难度:困难
3、选择题 CuCO3和Cu2(OH)2 CO3的混合物34.6克,可恰好完全溶解于300ml 2 mol·L-1的盐酸中,加热分解等质量的这种混合物可得CuO的质量为?(?)
A.16克
B.19.2克
C.24克
D.30.6克
参考答案:C
本题解析:略
本题难度:简单
4、选择题 某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液中一定含有(?)
A.Fe3+
B.Cu2+
C.Fe2+
D.Zn2+
参考答案:C
本题解析:某溶液中加入KSCN溶液无明显现象,说明原溶液不含Fe3+,再加入氯水,溶液立即变为血红色,说明反应有Fe3+生成,则原溶液中一定含有Fe2+,选择C项。3+和Fe2+的鉴别
点评:熟悉Fe3+和Fe2+的分别鉴别的方法
本题难度:简单
5、填空题 某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤
进行实验:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有?。 (填仪器名称)
(2)请写出加入氯水发生的离子反应方程式?。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是?
?;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是?。?
Ⅱ.有同学提出,还可以采用以下方法来测定:
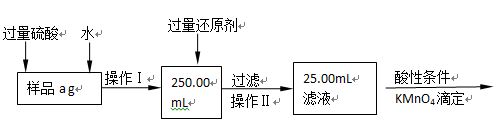
(1)选择的还原剂是否能用铁?(填“是”或“否”),原因是:?;
(2)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是:?。
参考答案:(11分)Ⅰ.(1)250mL容量瓶(1分)(2)2Fe 2++ Cl2= 2Fe 3++ 2Cl-(2分)
(3)再次加热冷却并称量,直至两次质量差小于0.1g(1分)
铁元素的质量分数是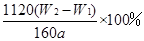 (2分) (2分)
Ⅱ.(1)否(1分)如果用铁做还原剂,自身的氧化产物是Fe2+;且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分,答出一个原因即给2分)
(2)铁元素的质量分数是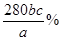 (2分) (2分)
本题解析::Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还需要的仪器有250mL容量瓶。
(2)氯水具有强氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式2Fe 2++ Cl2= 2Fe 3++ 2Cl-。
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为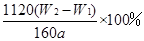 。Ⅱ.(1)还原剂不能用铁,因为铁会和过量稀硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定。 。Ⅱ.(1)还原剂不能用铁,因为铁会和过量稀硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定。
(2)设铁元素质量分数为x,则依据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O可知5Fe2+~5Fe3+~KMnO4
5×56?1
a×x× ? 0.001bc ? 0.001bc
则铁元素的质量分数是x=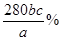
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,主要是考查学生实验分析,实验数据的计算应用,同时考查了实验知识的分析判断能力,有利于培养学生的综合实验能力,也有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。
本题难度:一般
|